バイオサイエンス研究科ストレス微生物科学研究室の高木博史教授らが、酸化ストレスから酵母を守るカギ酵素「Mpr1」の構造と反応機構を解明~食糧、エネルギー生産の産業酵母の改良や抗真菌薬の開発に期待
バイオサイエンス研究科ストレス微生物科学研究室の高木博史教授らは、独自に見出した酵母の酸化ストレス耐性機構において、カギ酵素である「アセチル基転移酵素Mpr1」の立体構造を明らかにした。また、得られた立体構造の情報をもとに、精製した酵素を用いた試験管内での実験や人為的に改変した変異型酵素を発現する酵母についての解析などを行い、Mpr1の反応機構や細胞内での機能を解明した。本研究の成果は高く評価され、平成25年7月1日付けで米国科学アカデミー紀要(Proceedings of the National Academy of Sciences of the United States of America)の電子版に掲載された。
高木博史教授のコメント
この論文は、先月本研究科で学位を授与された那須野亮さん(現・博士研究員)の主たる研究成果です。Mpr1は私が前任の福井県立大学生物資源学部で卒研生と発見した思い入れのある酵素です。既知のアセチル基転移酵素ファミリーにはないユニークな基質特異性(環状二級アミン)と生理機能(抗酸化)に興味を持ち、同じ学部の日竎先生と構造解析の共同研究を始めました。しかし、酵素としてはシンプルで扱いやすいのですが、結晶の性状が悪く、結晶化は困難を極め、何度か挫折しそうになりました。転機の一つは、当研究室に配属された那須野さんと本研 究科の箱嶋教授に相談し、自分たちで結晶化から始めようと決心したことです。彼の驚異的な頑張りと、X線結晶構造解析が専門の先生方(福井県立大学・日竎教授、伊藤講師、本研究科・箱嶋教授、平野助教)の多大なる協力のおかげで、基質との複合体構造や反応機構が明らかになりました。皆さんに改めて深く感謝いたします。私も自らの実験でMpr1に酵素活性を検出した時の喜びが蘇ってきました。諦めずに続けてきて本当に良かったと思います。今後、得られた構造情報をもとに、活性や安定性の向上した酵素を効率良くデザインし、有用酵母の育種などに応用したいと考えています。
究科の箱嶋教授に相談し、自分たちで結晶化から始めようと決心したことです。彼の驚異的な頑張りと、X線結晶構造解析が専門の先生方(福井県立大学・日竎教授、伊藤講師、本研究科・箱嶋教授、平野助教)の多大なる協力のおかげで、基質との複合体構造や反応機構が明らかになりました。皆さんに改めて深く感謝いたします。私も自らの実験でMpr1に酵素活性を検出した時の喜びが蘇ってきました。諦めずに続けてきて本当に良かったと思います。今後、得られた構造情報をもとに、活性や安定性の向上した酵素を効率良くデザインし、有用酵母の育種などに応用したいと考えています。
研究概要
【背景】
酵母Saccharomyces cerevisiaeは製パンや醸造、バイオエタノール生産など発酵産業において有用な微生物である。しかし、発酵プロセスにおいて高温、高浸透圧、冷凍、乾燥、高濃度エタノールなどの環境に曝されると細胞内の活性酸素種(ROS)レベルが増加し、酸化ストレス状態に陥るため、酵母の生育や発酵力が著しく阻害される。
高木教授のグループは、これまでに新規なアセチル基転移酵素Mpr1がプロリン・アルギニンの代謝を介して一酸化窒素(NO)の合成に関与し、酸化ストレスから酵母を防御していることを見出した(図1)。一方、Mpr1は既知のアセチル基転移酵素と類似性が低く、基質特異性も異なっている。既知のアセチル基転移酵素は一級アミン(アンモニア分子を構成する水素1個を炭化水素基で置換)を基質にするが、Mpr1は環状二級アミン(水素2個を炭化水素基で置換し、アンモニア分子を含めた環状構造)を代謝する(図2)。以上のことから、学術面(新規酵素の構造・機能)および応用面(酵母のストレス耐性・発酵能向上)の観点で興味深い酵素であるため、解析を行った。
【結果】
高木教授らは福井県立大学・日竎教授のグループ、および本研究科・箱嶋教授のグループとの共同研究によって、精製したMpr1タンパク質の結晶を調製し、X線結晶構造解析によりMpr1の立体構造を基質(シス-4-ヒドロキシプロリン)との複合体として原子レベルで明らかにした(図3)。その結果、既知のアセチル基転移酵素に保存される特殊な構造(β-bulge)を形成しないことで、基質である環状二級アミンの結合による立体障害を回避していることが示唆された。
また、立体構造からAsn135が基質の認識に、Asn178が反応の触媒に重要であると予測できた。実際にこれらのアミノ酸残基を人為的に別のアミノ酸に置換すると、Asn135の変異体は基質との親和性が、Asn178の変異体は触媒活性がそれぞれ著しく低下したことから、Asn135が基質の認識・結合に、Asn178が触媒活性にそれぞれ寄与していると結論付けた(図3)。さらに、これらの変異型Mpr1を酵母で発現させると、野生型Mpr1を発現する酵母に比べて、基質であるプロリン代謝中間体のレベルが増加し、反応が進まなかったことから、Asn135およびAsn178はMpr1の生理機能(酸化ストレス耐性)においても重要であることが明らかとなった。
【意義】
高木教授らが見出したMpr1は既知のアセチル基転移酵素と異なる基質特異性を有しているため、その立体構造と反応機構を明らかにしたことで、多くの重要な生命現象(遺伝子発現・タンパク質活性制御、薬剤・物質代謝など)に深く関わるアセチル基転移酵素について、基質認識や活性制御のメカニズムを酵素の構造と関連付けて理解するための情報が得られた。
また、抗酸化酵素であるMpr1の立体構造と反応機構を明らかにしたことで、酵素機能の向上した新しいMpr1(高い触媒活性・安定性など)の分子設計が可能となり、将来的には高度なストレス耐性、優れた発酵力を備えた産業酵母(パン類、酒類、バイオエタノールなど)の育種へ応用できる。
さらに、Mpr1をコードする遺伝子は酵母やカビなど真菌類にのみ保存されているため、立体構造と反応機構をもとに、Mpr1の活性や機能を特異的に阻害する低分子化合物を設計することで、新規な抗真菌剤(感染症薬、農薬など)の開発につながる可能性がある。
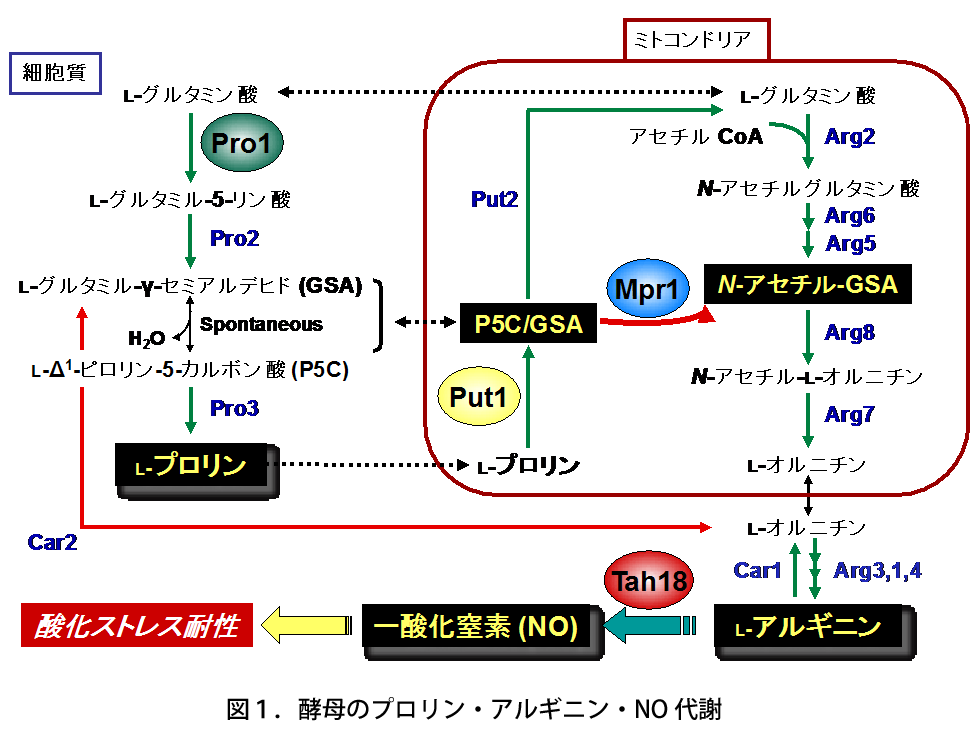
酵母S. cerevisiae Σ1278b株では、高温処理によって細胞内のROSレベルが増加するが(酸化ストレス)、Put1(プロリンオキシダーゼ)とMpr1(N-アセチルトランスフェラーゼ)の遺伝子発現が誘導され、プロリンからのアルギニン合成の亢進、続いてTah18タンパク質依存的なアルギニンからの一酸化窒素(NO)の合成により酸化ストレス耐性を獲得する。
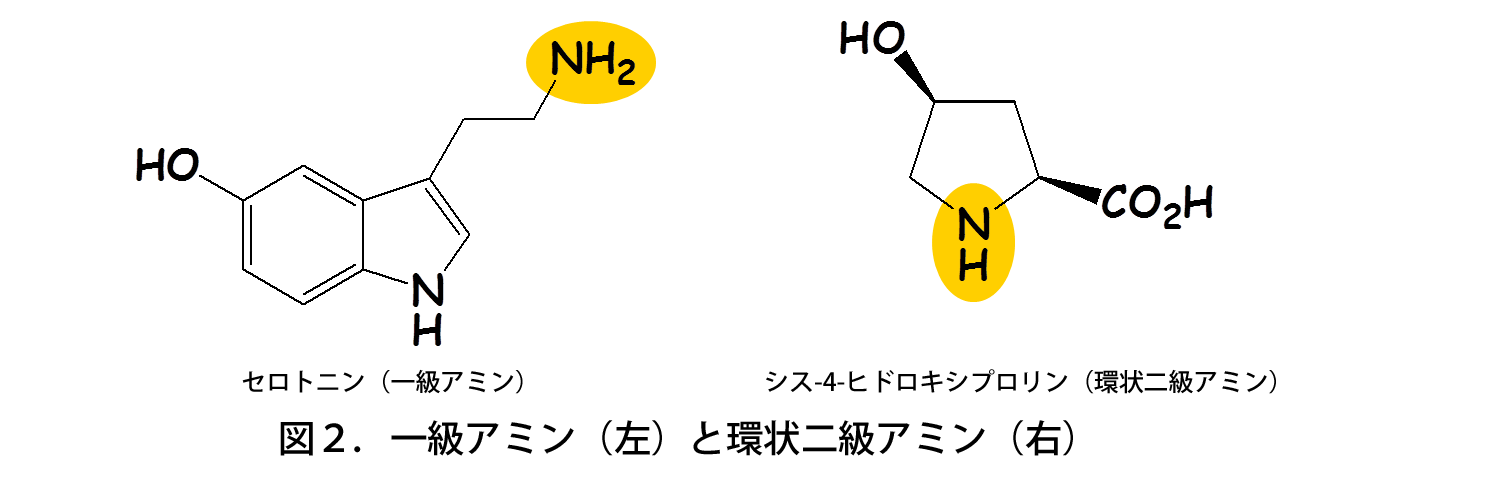
既知のアセチル基転移酵素は一級アミン(左)を基質とするが、Mpr1は環状二級アミン(右)を基質とする。黄色で示したのは、アセチル基転移酵素による修飾を受ける部位。
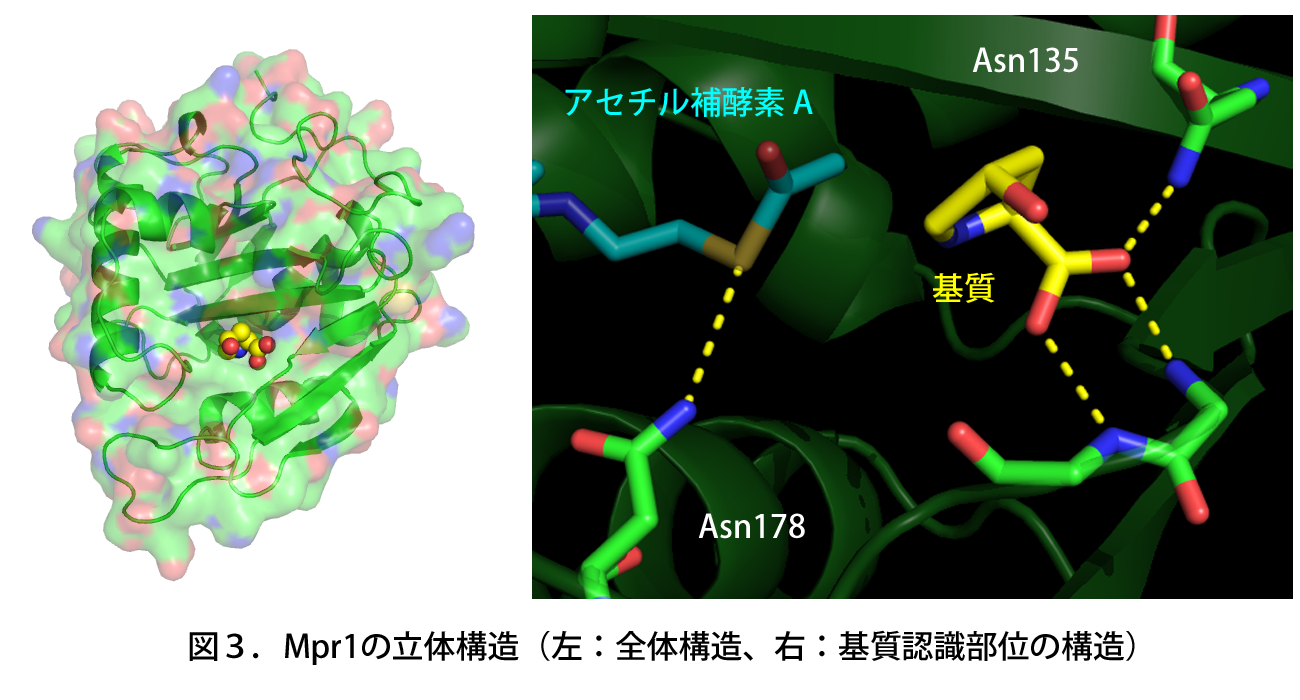
基質(黄)はMpr1内のAsn135により認識・結合され、Asn178がアセチル補酵素A(青)との相互作用により酵素反応を触媒する。
【共同研究者(共著者)】
福井県立大学 生物資源学部
教授 日竎 隆雄、講師 伊藤 貴文
奈良先端科学技術大学院大学 バイオサイエンス研究科
教授 箱嶋 敏雄、助教 平野 良憲
【関連する論文リスト】
- Nomura M, Takagi H (2004) Role of the yeast acetyltransferase Mpr1 in oxidative stress: regulation of oxygen reactive species caused by a toxic proline catabolism intermediate. Proc Natl Acad Sci USA 101(34): 12616-12621.
- Nishimura A, Kotani T, Sasano Y, Takagi H (2010) An antioxidative mechanism mediated by the yeast N-acetyltransferase Mpr1: oxidative stress-induced arginine synthesis and its physiological role. FEMS Yeast Res 10(6): 687-698.
- Nishimura A, Nasuno R, Takagi H (2012) The proline metabolism intermediate Δ1-pyrroline-5-carboxylate directly inhibits the mitochondrial respiration in budding yeast. FEBS Lett 586(16): 2411-2416.
- Nishimura A, Kawahara N, Takagi H (2013) The flavoprotein Tah18-dependent NO synthesis confers high-temperature stress tolerance on yeast cells. Biochem Biophys Res Commun 430(1): 137-143.
- Nasuno R, Hirano Y, Itoh T, Hakoshima T, Hibi T, Takagi H (2013) Structural and functional analysis of the yeast N-acetyltransferase Mpr1 involved in oxidative stress tolerance via proline metabolism. Proc. Natl. Acad. Sci. USA published ahead of print July 1, 2013, doi:10.1073/pnas.1300558110.
(2013年07月08日掲載)
 奈良先端科学技術大学院大学
奈良先端科学技術大学院大学