生体内を移動する細胞の基本的な振る舞いをとらえた足場となる繊維状タンパク質を 1 本のナノファイバーで再現
~がん細胞の転移の動的な仕組みの解明などに期待~
生体内を移動する細胞の基本的な振る舞いをとらえた足場となる繊維状タンパク質を1本のナノファイバーで再現
~がん細胞の転移の動的な仕組みの解明などに期待~
【概要】
奈良先端科学技術大学院大学(学長:塩﨑 一裕)先端科学技術研究科 バイオサイエンス領域 末次 志郎教授の研究グループは、生体内で浮遊する細胞が、周囲を取り巻く繊維状タンパク質のコラーゲンなど細胞外基質に接着し、これを足掛かりに移動する仕組みについて、超極細の繊維(ナノファイバー)を使い、細胞が繊維状タンパク質 1 本だけに接着した場合の移動の振る舞いを世界で初めて明らかにしました。これまで、複数の繊維状タンパク質が絡まった 3 次元の構造を形作るため、1 本ごとに細胞を培養して基本的な機構を観察するのが困難とされていたもので、がん細胞の転移などで起きる動的な現象を多角的に解明できると期待されています。
今回は、共同研究している米国バージニア工科大学の Amrinder Nain(アムリンダー ナイン)准教授らによって開発された、極細のポリスチレン繊維(直径 135 ナノメートルと 500 ナノメートル)の上で細胞を培養できる一連の技術を用い、1 本の上での細胞の運動を観察しました。その結果、細胞の運動は、末次教授らがこれまで明らかにしてきた細胞の移動のために細胞表面に突起を作るシステム(アクチン細胞骨格制御システム)と細胞膜の形状を制御するシステム(I-BAR ドメインというタンパク質による膜形態形成システム) の協調によって、2 次元や 3 次元の細胞運動と同様に制御されていることがわかりました。さらに、アクチン細胞骨格システムは、細胞全体が移動する際に、細胞の核を引っ張り込む役割をすることを突き止めました。
研究に使った超極細繊維は細胞外基質の繊維の 1 本に相当し、この細胞の移動様式は、最も根源的な仕組みであると考えることができます。
この研究成果は、米国 Wiley 社の学術誌「Advanced Science」に令和 5 年 3 月 3 日に掲載されました。
今回の研究は、Amrinder (アムリンダー)准教授、イスラエル・ワイズマン科学研究所の Nir Gov(ニル ガブ)教授、理化学研究所の清末優子チームリーダーらと共同で行われました。
また、研究成果は、科学研究費補助金 基盤研究(B)、基盤研究(S)、国際共同研究(A)、戦略的創造研究推進事業 チーム型研究(CREST)、武田科学振興財団などの事業・研究領域・研究課題によって得られました。
<論文タイトル>
Actin Filaments Couple the Protrusive Tips to the Nucleus through the I-BAR Domain Protein IRSp53 during the Migration of Cells on 1D Fibers (I-BAR ドメインを持つ IRSp53 によって、細胞の移動先端と細胞核の細胞移動における協調が、1 次元繊維上でなされる。)
doi:10.1002/advs.202207368
【解説】
細胞移動の機構は、がん細胞の転移や発生に伴う細胞の再配置など、生命の根源的な現象の解明につながることから、盛んに研究されています。細胞の移動様式として、生体内では 3 次元の細胞外基質中がほとんどであると考えられ、コラーゲンなどの繊維状タンパク質が複雑に絡み合った形状であるため、その最小単位である 1 本の繊維での細胞の移動がどうなっているか、明らかではありませんでした。一方、高精細な顕微鏡観察に基づく細胞移動機構の解明は、観察に適したカバーガラスなどの薄いガラス板状に細胞外基質を塗布することで細胞を接着させ、観察を行うことで得られてきました。
このため、1 本の細胞外基質繊維で細胞移動に十分であるか、またその分子機構はこれまで知られている 2 次元、および 3 次元の細胞の移動様式と共通点があるかどうかについて明らかではありませんでした。
細胞突起はこれまでに、細胞の移動のための構造であると考えられていました。末次教授らは、細胞の脂質膜(生体膜)の微細な形態形成を担う BAR ドメインと呼ばれるタンパク質モジュール(機能を持ったタンパク質の 1 部分)の研究を行ってきました。BAR ドメインは、タンパク質が生体膜上で集まり、ブロックのような形態を作ることで、生体膜の形態を制御するタンパク質ドメインです。細胞突起は、BAR ドメインの一種であるI-BAR ドメインによる細胞膜の変形によっても生じることが、末次教授らにより明らかになっていました。これらの変形した細胞膜は、I-BAR タンパク質と協調して制御されるアクチン細胞骨格という細胞内の繊維によって強度を付与され、運動装置として完成すると考えられてきました。
本研究では、バージニア工科大学の Amrinder Nain 准教授らによって開発された 135 nm および 500 nm の直径のごく細いポリスチレン繊維と、その上で細胞を培養できる一連の技術を共同研究で使い、1 本の上での細胞の運動を観察しました。その運動が、末次教授らがこれまで明らかにしてきたアクチン細胞骨格制御システムと細胞膜の形状を制御する I-BAR ドメインによる膜形態形成システムの協調よって、2 次元および 3 次元の細胞運動と同様に制御されていることを明らかにしました。ところが、1 次元では細胞突起は 2 次元、3 次元よりも形成速度やサイズが大きいコイリング(渦巻状)様式を取ること、コイリングは、I-BAR ドメインを持つタンパク質 IRSp53 に依存することを明らかにしました。また、理化学研究所の清末チームリーダーらと共同で、格子光シート顕微鏡を用いることで、アクチン繊維のダイナミクス(分子動態)が IRSp53 に依存することも明らかにできました。
さらに、詳細な運動様式の解析の結果、I-BAR ドメインによって協調的に駆動されるアクチン細胞骨格システムは、細胞の核を細胞全体が移動する際に、引っ張り込む役割をすることを明らかにしました。この細胞の核が、細胞全体の移動に伴ってどのように協調して移動するかについてはほとんど明らかになっていなかったので、この点でも新規性があります。
【今後の展開】
細胞の培養基質は細胞の産業応用において重要ですが、その基質の形状について、人工繊維の使用の可能性を示すことができたと考えられます。1 次元では細胞の突起構造の亢進が見られ、その機序は、2 次元培養と同じであることがわかりました。細胞突起は細胞外小胞のもとにもなることが同グループにより示 されています。そこで、細胞の突起に由来する細胞外微粒子の産生の効率化などに適した培養基材の開発に資すると考えられます。また、細胞外基質と細胞との接着機構の解明により、がん細胞の転移機構の解明などにも資すると考えられます。
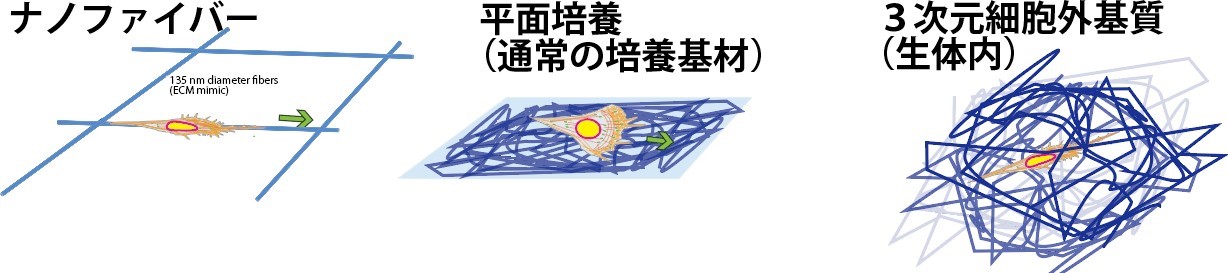
図 1 細胞培養に用いられる基質の形状
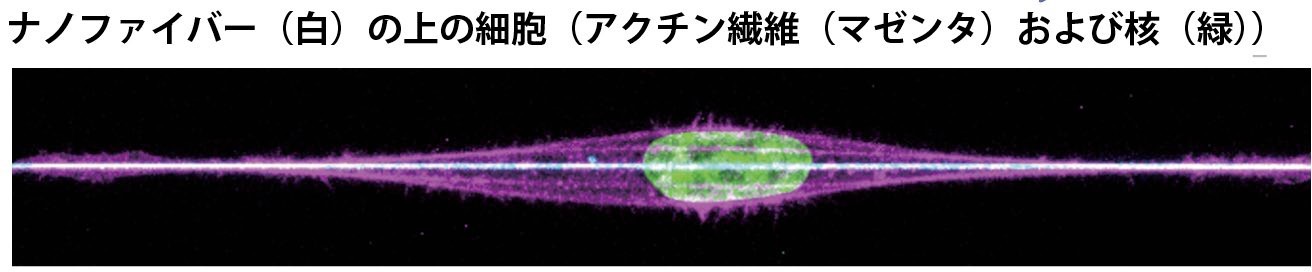
図 2 直径135 nm 繊維に接着した細胞
【用語解説】
(*1)細胞突起(フィロポディア)
糸状仮足ともよばれ、運動性が高く、細長い細胞表面の突起構造。
(*2)細胞運動
細胞が動くこと。細胞は、細胞外基質との接着構造形成を組み替えることで移動する。
細胞突起や葉状仮足(ラメリポディア)を移動先端で形成し、細胞膜を移動方向に伸ばし、その先で新たな接着構造を形成する。一方で、細胞の後方の接着構造は、回収され、さらに細胞の後方を収縮させる。この一連の動きで細胞が移動する。この移動は、がん細胞が原発巣から移動する際(転移)や、神経回路形成などさまざまな場面で見られる。
(*3)細胞外基質
コラーゲン、フィブロネクチンやラミニンなどの細胞外に分泌され、ゲル状の構造が形成可能なタンパク質。細胞が接着し増殖するための足場となるほか、細胞と細胞の間を満たし組織の支持体にもなる。
(*4)Bin-Amphiphysin-Rvs (BAR)ドメイン
BAR ドメインはカーブ構造をしており、脂質膜に結合することで、タンパク質の形を鋳型として、小胞を含む脂質膜の形態を形成します。このように生体膜の形を制御するタンパク質としては、ほとんど唯一知られているタンパク質です。BAR ドメインは、BAR、F-BAR、I-BAR の 3 種に大別されます。この中で、I-BAR ドメインは主に細胞突起形成に関与すること、F-BAR ドメインおよび BAR ドメインは、主にエンドサイトーシス(飲食作用)に関与することがわかっていました。
(*5) 格子光シート顕微鏡
薄い光シートを用いて、細胞などの観察対象を走査して断面画像を連続的に取得することで、立体的な画像を高速で取得する顕微鏡。従来の顕微鏡と比較すると、光シートを用いることで、焦点深度方向の解像度が飛躍的に向上し、細胞全体を俯瞰しつつ高精度で観察することが可能となりました。格子光シート顕微鏡は、米国ハワード・ヒューズ医学研究所の Betzig 研究室ににおいて開発され(Science 346, 6208, 2014)、その技術情報に基づいて、理化学研究所と JST CREST 事業により、清末研究チームで構築・運用されているものを用いました。
【分子医学細胞生物学研究室】
研究室紹介ページ:https://bsw3.naist.jp/courses/courses210.html
研究室ホームページ:https://bsw3.naist.jp/suetsugu/
(2023年03月22日掲載)
 奈良先端科学技術大学院大学
奈良先端科学技術大学院大学