タンパク質膜透過に関わる新規因子YfgM/PpiD複合体の細胞内機能・構造の解析
タンパク質膜透過に関わる新規因子YfgM/PpiD複合体の細胞内機能・構造の解析
[概要]
生物の約30%のタンパク質は細胞質外に輸送されて機能すると言われています。それらタンパク質の膜を越えた輸送には保存されたタンパク質膜透過装置Sec複合体が重要な役割を果たします。グラム陰性細菌の大腸菌では、SecY/E/G複合体がタンパク質の透過孔を形成し、2種のモータータンパク質SecA ATPaseとSecD/F複合体が基質の膜透過を駆動すると考えられています(図1)。我々 は以前にPpiDという膜タンパク質がSecD/F複合体と直接相互作用し、タンパク質膜透過反応の後期過程に働くことを見出しました。さらに、膜タンパク質YfgMはPpiDと複合体を形成し、SecY/E/G複合体と相互作用することが報告されていました(図1)が、その具体的な役割は不明でした。
まず、YfgMの変異株を用いた解析から、YfgMがPpiD同様にタンパク質膜透過反応の後期過程に重要であること、YfgMはPpiDを安定化することを示しました。また、YfgMとPpiDはそれぞれのパートナー因子が存在する時のみSecY/E/G複合体と相互作用することも見出しました。これらの結果は、YfgMとPpiDは複合体を形成することでSecY/E/G近傍でタンパク質膜透過反応に働くことができるようになることを示唆します。
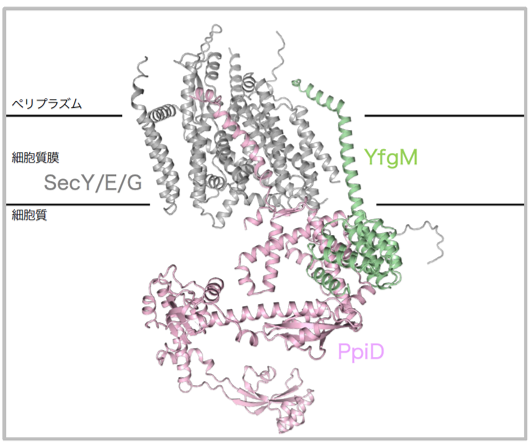
また、YfgMがPpiDやSecY/E/Gとどのように相互作用しているかを明らかにするために、in vivo光架橋法を用いて生細胞内でのアミノ酸残基レベルの詳細な相互作用様式を調べ、それぞれの因子との架橋部位をいくつか同定しました。驚くべきことに、in vivo光架橋法の架橋部位は、AIを用いた高精度のタンパク質立体構造予測プログラムAlphaFold2の複合体予測構造とよく一致していました(図2)。この複合体の予測構造は以前に報告された架橋解析とも全て一致しており、これまで構造未知のYfgM/PpiD複合体は細胞内でこのような構造を取り得ると考えられます。
本発表論文では、上記の点を明らかにしたものの、YfgM/PpiD複合体がどのように基質と相互作用し、下流のペリプラズムシャペロンに受け渡すか等のタンパク質膜透過・輸送機構に関しては不明な点が多く残されています。今後は、生化学的解析や構造解析を進め、YfgM/PpiD複合体とSec複合体が協働するタンパク質膜透過の分子機構の解明を進めます。
【掲載論文】
論文タイトル:"Inner membrane YfgM–PpiD heterodimer acts as a functional unit that associates with the SecY/E/G translocon and promotes protein translocation"(内膜のYfgM-PpiDヘテロ二量体はSecY/E/Gトランスロコンと相互作用し、タンパク質膜透過を促進する機能ユニットとして働く)
Ryoji Miyazaki, Mengting Ai, Natusko Tanaka, Takehiro Suzuki, Naoshi Dhomae, Tomoya Tsukazaki, Yoshinori Akiyama, Hiroyuki Mori(宮崎 亮次、艾 梦婷、田中 夏子、鈴木 健裕、堂前 直、塚崎 智也、秋山 芳展、森 博幸)
J. Biol. Chem., 102572, (2022), DOI: 10.1016/j.jbc.2022.102572
【構造生命科学研究室】
https://bsw3.naist.jp/courses/courses309.html
https://bsw3.naist.jp/tsukazaki/
図1 YfgM/PpiDとSec複合体の模式図
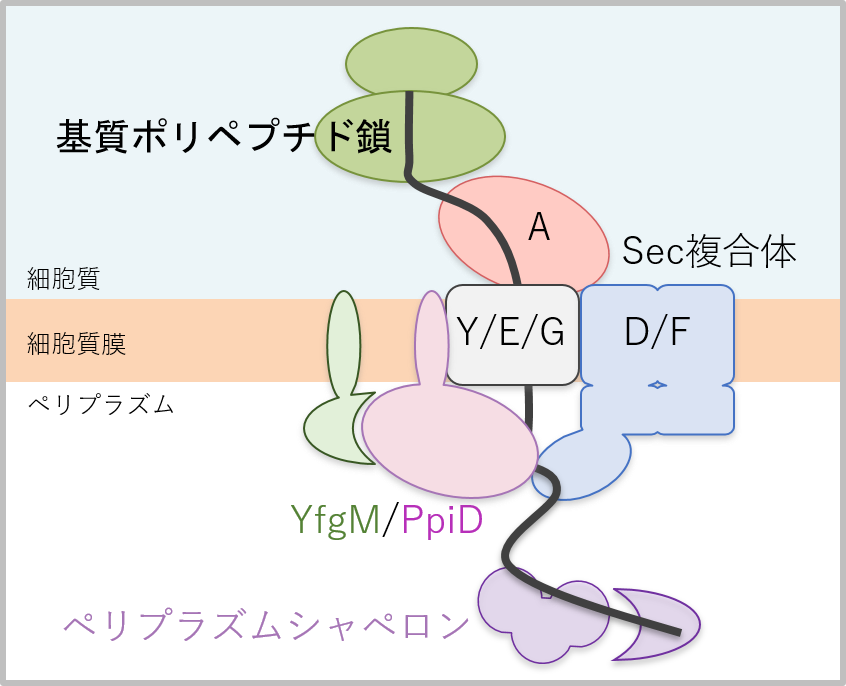
図2 YfgM/PpiD-SecY/E/G複合体のAlphaFold2予測構造
(2022年10月13日掲載)
 奈良先端科学技術大学院大学
奈良先端科学技術大学院大学