「デザイナーズ組織」の実現
~人工コラーゲンを基材とする再生医療への期待~
「デザイナーズ組織」の実現
~人工コラーゲンを基材とする再生医療への期待~
【概要】
我が国に代表される超高齢社会を迎えた現在、疾患並びに加齢等により機能不全あるいは部分不全に陥った組織や臓器を対象とした再生医療研究は注目を浴び、その成果創出への期待が高まっています。再生医療には大きく分けて2つの大きな流れがあります。
① 幹細胞を分化させ、望む組織や臓器を再生する方法
② 生体適合性の材料を用いて機能を代替する装置を作成する方法
本学(当時)の山中伸弥教授によって、幹細胞として倫理的障壁の低いiPS細胞が開発されたことにより、①の方法が注目を浴びています。しかし、特定の幹細胞の分化を生体内の任意の場所で適時に誘導することは、これまで切望されていたものの極めて困難でした。
今回小林未明博士らは、本学で開発された人工コラーゲンを基材として、骨髄性体性幹細胞の分化を外部からの刺激によって時空間的に制御できる生体適合性材料を開発することに成功しました。外部刺激として可視光領域のレーザを用いていることから、生体内に埋め込んだ後でも制御することが可能であり、一つの幹細胞からあらゆる組織・臓器を自由自在に“デザイン”し作製できる新技術「デザイナーズ組織」の実現に近づくことができました。
【開発の背景】
前述のとおり、再生医療には大きく分けて、 幹細胞を分化させて望む臓器や組織を再生する方法と、生体適合性の材料を用いて機能を代替する装置を作製する方法の大きく二つの手法があります。幹細胞(多能性幹細胞)としては、従来「ES細胞」と呼ばれる細胞が使われてきました。しかし、ES細胞の作製には卵子を必要とし、初期胚を破壊する必要があります。一方、2006年に本学(当時)の山中伸弥教授らによって開発されたiPS細胞は、卵子を必要とせず、人工的に作製することが可能で倫理面での障壁が少ないこと、患者本人の細胞からも作成出来るため、細胞療法に用いても免疫拒絶反応の可能性が低いこと等から、再生医療の研究で活用されることが強く期待されてきました。2014年には、世界で初めてiPS細胞を用いた加齢性黄斑変性症の移植手術が行われた他、横浜市立大学では、ヒトiPS細胞から肝臓を簡易的に真似たミニ肝臓の大量製造に成功しています。しかしながら、複雑な臓器や組織を作製し、それらに本来のものと同等の機能を持たせるには至っていません。また、臓器や組織を形成する細胞をiPS細胞から分化誘導する場合、体外で行われることがほとんどです。これは目的の細胞に分化させるには必要な刺激だけをタイミングよくiPS細胞に与える必要があるからです。
【開発技術のポイント】
このようなニーズに対応するため、外部からの刺激によって時空間的に細胞分化を制御可能にする材料の研究が各国で進められてきました。その基本的な概念は証明されていましたが、これまで真に生体適合性の高い材料を用いて実証試験を行った例はありませんでした。
今回小林未明博士らは、本学で開発された人工コラーゲンを基材とした、幹細胞の分化を外部からの刺激によって時空間的に制御できる生体適合性材料を開発することに世界で初めて成功しました。この方法では外部刺激として可視光領域のレーザを用いているため、生体内に埋め込んだ後でも制御が可能であり、一つの幹細胞からあらゆる組織や臓器を自由自在に“デザイン”し作成できる新技術「デザイナーズ組織」実現に大きく近づいたと言えます。
ちなみに、今回の実験で用いた人工コラーゲンは、製造工程においてウイルスなどの病原体が混入する危険性が低く、動物実験を通じて安全性が確保され、すでに化粧品分野などで実用化されているものです。
なお、本研究成果は、研究機関が総力をあげて取り組む共同研究を対象とする公益財団法人武田科学振興財団の特定研究助成による支援を受けて、バイオサイエンス研究科・佐藤匠徳教授、物質創成科学研究科・谷原正夫教授、情報科学研究科・湊小太郎教授(いずれも当時)の三分野融合研究として推進されてきました。
https://bsw3.naist.jp/research/index.php?id=664
革新的技術の開発・実用化を目指して異分野融合研究が奨励され、サポート体制の整った本学の特徴を活かした研究成果と言えます。
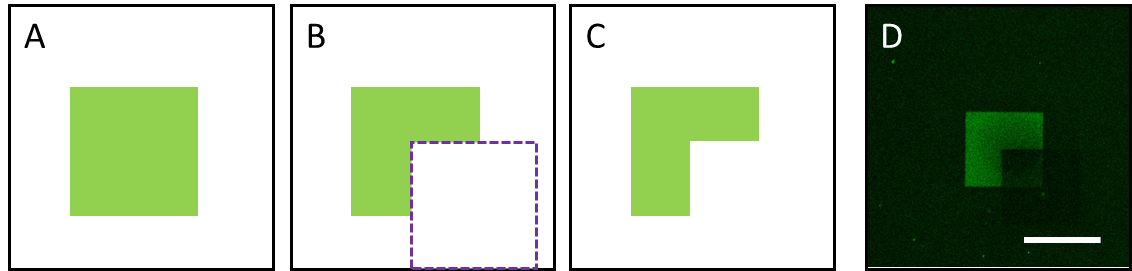
図1 人工コラーゲンを基材とし、まず緑の領域にレーザ(488nm) 照射して骨分化誘導
ペプチドを固定(A)。その後、任意の領域(紫)にレーザ(405nm)照射(B)することにより、その部分のペプチド(分化シグナル)を除くことが出来る(C)。モデル化合物を用いた実物の顕微鏡像(D)。スケールバーは200 μm。
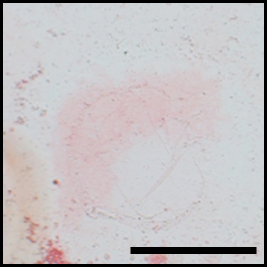
図2 図1の手順で作成した基材上で幹細胞を培養し、カルシウムを赤く染める特殊な試薬で処理すると、骨分化へのシグナルが残っている領域のみが染色された。骨への分化が、あらかじめデザインされた領域のみで進行していることが判った。
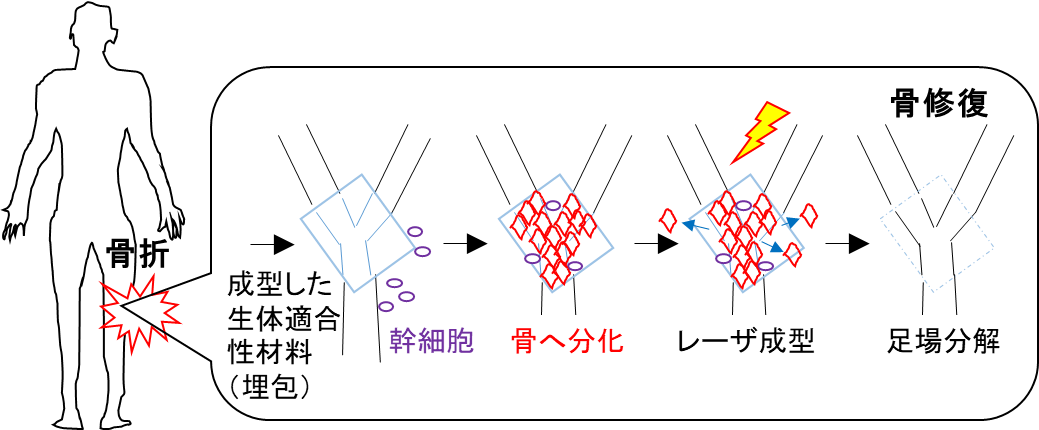
図3 考えられる応用例。骨折部に成型したレ生体適合性足場材料(人工コラーゲン)を埋め込み、体外からレーザ照射で骨髄性体性幹細胞の骨分化を制御して、形を整えながら骨を修復する。コラーゲンは自然分解する。
【社会貢献度】
人工コラーゲンを基材とし、本学で開発された骨分化誘導ペプチドをレーザ光で脱着することにより、任意の場所で幹細胞の骨への分化を誘導出来ることを実証しました。細胞分化を誘導する因子は、他にも様々なものが知られていますが、これらを組み合わせて 任意の場所、時間での細胞分化をデザインすることによって臓器への分化を実現できれば、実際の医療への貢献は計り知れません。
【山中伸弥教授とともに、長年iPS研究に携わってきた大阪医科大学 友田紀一郎准教授のコメント】
「iPS細胞の分化を、生体内でも任意の場所/タイミングで誘導出来る技術が確立されれば、狙った臓器や組織を体内の必要な場所で必要量作製することが可能となるかもしれない。その第一歩となる重要な研究結果である。」
【今後の展開】
数年間に亘る学内での異分野融合研究の成果としての第一歩を踏み出すことができ、すでに海外の研究者との共同研究も始まっています。引き続き、我が国の医学の発展に向け、国内外の研究者と研究開発を続けるとともに、パートナー企業を得て、実際の医療に貢献できる成果を目指します。
【用語解説】
・幹細胞:
多機能の細胞へ分化する能力を持った細胞。「多能性幹細胞」と呼ばれ、ほとんどの種類の細胞に分化する能力をもつものと、「体性幹細胞」と呼ばれて、限られた細胞系譜にのみ分化する能力を持つものがある。多能性幹細胞には大きく分けて胚性幹細胞(ES細胞)と体細胞由来で作製できるiPS細胞がある。iPS細胞は、2006年にマウスを用いた実験で本学(当時)の山中伸弥教授よって発明された。翌年ヒトでも実証され、再生医療への応用が期待されている。ES細胞は、出発材料として卵子を扱うため、ヒトES細胞を取り扱う上では倫理的な問題を内包する。一方、iPS細胞は、体細胞を用いて作製するため、倫理面での問題を大きく軽減している。
体性幹細胞:
限定した分化能を持ち、最終的に分化する細胞種が限られている。骨髄性幹細胞(骨、軟骨、脂肪細胞等へ分化可能)の他に神経幹細胞、血液幹細胞等がある。もともと体内に存在するが、その数は限られている。
・コラーゲン:
動物の皮膚や骨などを構成するたんぱく質のひとつ。人体内に存在している全たんぱく質の約1/3を占める。コラーゲンの総量は、ヒトでは、全タンパク質のほぼ30%を占める。保湿剤として化粧品に用いられているほか、心臓弁や手術用の糸、やけどの治療など、医療分野でも多く利用されている。
・人工コラーゲン:
コラーゲンを構成するアミノ酸である、プロリン、ヒドロキシプロリン、グリシンが繰り返した構造を持つ。谷原研究室で開発され、天然コラーゲンに比べて構造が安定している。アミノ酸の合成によって作成されることから、動物由来のコラーゲンと異なり、プリオンやウイルスなど病原体の混入する危険性が低い。化粧品分野などですでに実用化されている。
・足場材料:
細胞は単独では生きていくことができず(血球系など一部を除く)、足場材料と呼ばれる物質の存在が不可欠である。通常の体内では、コラーゲンを含む「細胞外マトリクス」を足場としている。
・ペプチド:
アミノ酸数個から数十個が繋がった、機能的物質。骨分化を誘導するもののほか、ホルモンなどとして、医薬品そのものとして用いられることもある。
・骨分化誘導ペプチド:
骨形成因子BMP4の一部分で、骨分化誘導能を持つペプチド。アミノ酸20個が繋がった構造を
持つ。2004年に谷原研究室で開発された。
【論文情報】
論文タイトル:Optical control of cell differentiation on synthetic collagen-like scaffolds
雑誌名:Journal of Biomaterials Science, Polymer Edition (2019) 30:1161-1171.
著者:Mime Kobayashi*, Ryosuke Honda, Tsuyoshi Ando, Masao Tanihara
DOI番号:10.1080/09205063.2019.1622845
【原著論文URL】
https://www.tandfonline.com/doi/full/10.1080/09205063.2019.1622845
【関連特許出願】
幹細胞培養用基材及びそれを用いた培養方法
Substrate for stem cell culture, and culture method using same
発明者:谷原正夫、佐藤匠徳、幸得友美、柴崎賀彰
国際公開番号 WO/2013/002311 公開日2013年1月3日
【花発生分子遺伝学研究室】
研究室紹介ページ:https://bsw3.naist.jp/courses/courses112.html
研究室ホームページ:https://bsw3.naist.jp/ito/
(2019年11月26日掲載)
 奈良先端科学技術大学院大学
奈良先端科学技術大学院大学