バイオサイエンス研究科分子医学細胞生物学研究室の末次志郎教授らが、生理的に重要なイオンを運ぶ通り道TRPV4の新たな制御機構を解明
(~脂質膜とタンパク質が相互作用、病気の解明や創薬に期待~)
バイオサイエンス研究科の末次志郎教授らと、国立大学法人京都大学(総長:松本紘)大学院工学研究科の森泰生教授、高橋重成特定助教、国立大学法人東京大学(総長:濱田純一)分子細胞生物学研究所の北尾彰朗准教授、国立大学法人九州大学(総長:有川節夫)生体防御医学研究所の嶋田睦准教授、神田大輔教授の共同研究グループは、生物の細胞膜内にあり、温度や浸透圧に制御されてイオンが透過する通り道をつくるセンサータンパク質である「TRPV4」というイオンチャネルについて共同研究を行い、このタンパク質が細胞膜に含まれる特定の脂質に結合することを発見しました。この現象によってイオンチャネルが閉じるという新たな制御の仕組みの一端を初めて解明しました。このイオンチャネルの変異は筋萎縮症や構音障害や呼吸筋麻痺などの病気との関連が指摘されていますが、研究では特定の脂質と結合する力が弱まっていることもわかり、病気の原因の解明や創薬にも役立つと見られます。
TRPV4は、細胞膜の内外のイオンの濃度差によってイオンを透過させるイオンチャネルであり、低浸透圧や温度によってチャネル活性が制御されていることが知られています。また、筋肉の病気である筋萎縮症や構音障害や呼吸筋麻痺を特徴とするシャルコーマリートゥース病(CMT)に罹患しやすい家系の一部ではそのアミノ酸配列に多数の変異が報告されています。しかし、TRPV4チャネルは細胞膜で機能するにもかかわらず、細胞膜に含まれるリン脂質による制御は明らかではありませんでした。
今回、われわれはTRPV4分子を構成する「アンキリンリピートドメイン(領域、注2)」というアミノ酸の繰り返し配列部位が、細胞膜に含まれるリン脂質「PI(4,5)P2」と結合することを明らかにしました。これは、PI(4,5)P2(注3)の一部を構成するイノシトール3リン酸(IP3)とアンキリンリピートドメインが結合した状態の共結晶を用い、3次元構造を調べるX線結晶解析(注4)という手法や生体高分子の挙動を推測する分子動力学計算(注5)の結果をもとに、PI(4,5)P2結合サイトの候補を同定しました。この結合部位が変異して脂質と結合しない場合には、チャネルを開く形の活性の増大をもたらしました。また、筋萎縮症やCMTにおける変異したTRPV4のいくつかで、脂質結合活性の減弱が認められました。このことはTRPV4とPI(4,5)P2の結合は、チャネル活性を負(閉じる形)に制御し、筋萎縮症やCMT疾患においては、この制御が失われていることを示唆すると考えられます。
今回の成果は、最先端次世代研究開発プログラムの研究テーマ「細胞膜メゾスケール構造構築とがん形成機構」(研究者:末次志郎)の一環として行なわれたもので、成果の詳細は英国の学術雑誌『Nature Communications』オンライン版9月26日号に掲載されました。
末次志郎教授のコメント
脂質は、核酸やタンパク質ほど注目されていませんが、細胞の必要不可欠な構 造物を形成します。今後も脂質-タンパク質の相互作用を中心に、脂質のの驚くべき機能を明らかにしていきたいと考えています。
造物を形成します。今後も脂質-タンパク質の相互作用を中心に、脂質のの驚くべき機能を明らかにしていきたいと考えています。
【解説】
[研究背景]
タンパク質は、遺伝子によって直接アミノ酸配列が決定され、その機能は生命活動にとって重要であることは間違いありません。しかし、生命の最小単位である細胞は、脂質膜で構成される細胞膜をもち、細胞内外を区別しています。細胞膜には、イオンやその他の物質を通過させるためのタンパク質装置が存在します。これらにはイオンチャネルが含まれ、イオンチャネルは、細胞膜のイオン透過性を調節することで細胞が外界の変化に対して反応するために働いています。また、イオンチャネルの異常は、さまざまな疾患と関連していることが知られています。しかし、イオンチャネルは、脂質膜に埋まっているにもかかわらず、イオンチャネルと脂質膜を構成する脂質との関連はそれほど明らかになっていませんでした。
TRPV4は、熱さや冷たさなどの温度の認識と代謝制御や、引っ張りなどの機械刺激の認識に重要であると考えられているイオンチャネルです。また、筋肉萎縮症や構音障害や呼吸筋麻痺を特徴とするシャルコーマリートゥース(CMT)病という神経疾患を発症する家系の一部には、TRPV4に変異が見いだされることが知られていました。
[研究成果と今後の展開]
タンパク質はいくつかのタンパク質ドメイン(領域、注6)と呼ばれる機能単位が連結されて構成されています。細胞膜に存在するイオンチャネルは、細胞外、膜貫通(チャネル)、細胞内の三つの部分から構成されています。今回、われわれは、TRPV4の細胞内ドメインに注目しました。この細胞内ドメインは、「アンキリンリピートドメイン」と呼ばれています。この領域は、イオンチャネルに限らず、さまざまな多数のタンパク質に見いだされます。しかし、アンキリンリピートドメインと脂質膜の関連は調べられていませんでした。
今回、TRPV4のアンキリンリピートドメインと脂質膜の結合を調べたところ、PI(4,5)P2という脂質に比較的強く結合することがわかりました。さらに、この結合を、タンパク質立体構造解析や分子動力学、生化学的方法、生理学的方法を組み合わせて確認しました。興味深いことに、TRPV4のアンキリンリピートドメインとPI(4,5)P2の結合は、TRPV4の関わる筋萎縮症などの病気に罹患しやすい家系で見いだされた変異で減弱している場合がありました。このことは、PI(4,5)P2という脂質によるTRPV4のチャネル制御の重要性を示しています。
イオンチャネルの細胞内ドメインが、本研究で示したようにタンパク質の立体構造に基づいて脂質膜に結合する例は、ほとんど知られていませんでした。タンパク質の立体構造に基づく脂質膜の認識は、明確なTRPV4イオンチャネルの制御機構を示し、TRPV4の制御機構の解明に役立つと考えられています。このことは、もちろんTRPV4を標的とした創薬研究を含むさまざまな研究に役立つと考えられます。
[用語解説]
(注1) イオンチャネル:細胞膜を含む生体膜は、水になじむ親水性の部分と、なじまない疎水性の部分を併せ持つ両親媒性脂質より構成されています。生体膜は、両親媒性脂質の疎水性の部分が互いに水中で向き合うことにより膜を形成するために、イオンのような水溶性の電荷をもった物質は電気的に反発し、きわめて通りにくいと考えられています。このため、生体膜のイオン透過性は、脂質膜に埋め込まれて存在するタンパク質であるイオンチャネルやイオンポンプにより担われています。生体膜の内外にはイオンの濃度差があり、濃度差にそってイオンを透過させるものがイオンチャネルであり、濃度差に逆らってイオンを輸送するものがイオンポンプです。それぞれ細胞のおかれた状態に応じて開閉があると考えられています。
(注2) アンキリンリピートドメイン:アンキリンリピートドメインは、ヒトにおいても500種以上、全生物においては2000種以上のタンパク質に現れるタンパク質ドメインです。これまでタンパク質間相互作用を担うドメインであると考えられてきました。本研究によってすべてのアンキリンリピートドメインと脂質膜との結合が示される訳ではありませんが、これまでに解析されていないタンパク質のアンキリンリピートドメインのうちのいくつかは、脂質膜と結合する可能性が考えられます。
(注3) PI(4,5)P2:細胞膜を構成する脂質には、フォスファチジルイノシトール(PI)と呼ばれるものがあります。他の細胞膜を構成する脂質と異なり、フォスファチジルイノシトールは、酵素によってリン酸を付加(修飾)されることが知られています。リン酸を付加されたフォスファチジルイノシトールは、7種が知られています。そのなかでも、PI(4,5)P2は、細胞の増殖を制御するための細胞内シグナル伝達に重要であることが知られていました。フォスファチジルイノシトールのリン酸付加酵素の異常はがんなどの様々な病気に関連することが知られています。
(注4) X線結晶構造解析法:タンパク質も、他の物質と同じように結晶をつくることができます。X線を当てると、結晶中の繰り返し構造を反映した回折像が得られます。これをもとに、タンパク質の中の原子の3次元配置つまり、分子の三次元構造を決定することができます。強力なX線を用いると、詳しい回折像が得られるので、兵庫県にある大型放射光施設「SPring-8」や茨城県にある「photon factory」といった、シンクロトロンでの放射X線が用いられます。
(注5) 分子動力学:コンピュータを用いて、分子運動の模擬実験を行い、分子の性質や会合を推定する方法です。X線結晶構造解析法などで得られたタンパク質を構成する原子の位置を用いて、タンパク質の振る舞いを予測することができます。
(注6) タンパク質ドメイン:多くのタンパク質は機能および立体構造で分けられる機能単位(機械を構成するモジュールを想像するとわかりやすいかもしれません)の組み合わせによってできています。この機能単位をタンパク質ドメインと呼びます。タンパク質ドメインは、多くのタンパク質に共通し、かつ、さまざまな組み合わせで現れます。言い換えれば、それぞれのタンパク質は、異なるタンパク質ドメインの組み合わせによってつくられ、独自の機能を発揮しているということができます。
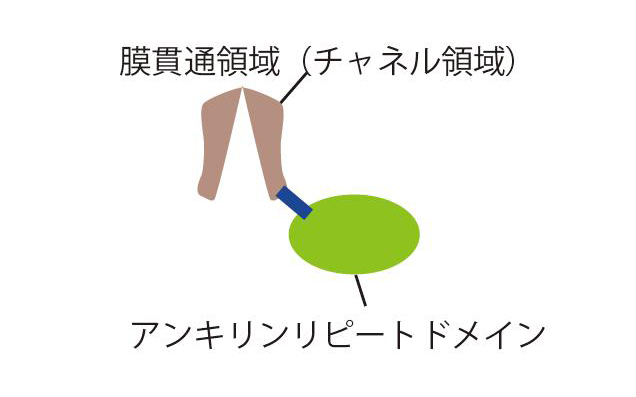
図1 TRPV4の全体構造:主にチャネル活性を担う膜貫通とアンキリンリピートドメインからなる。アンキリンリピートドメインは、細胞内側に存在する。
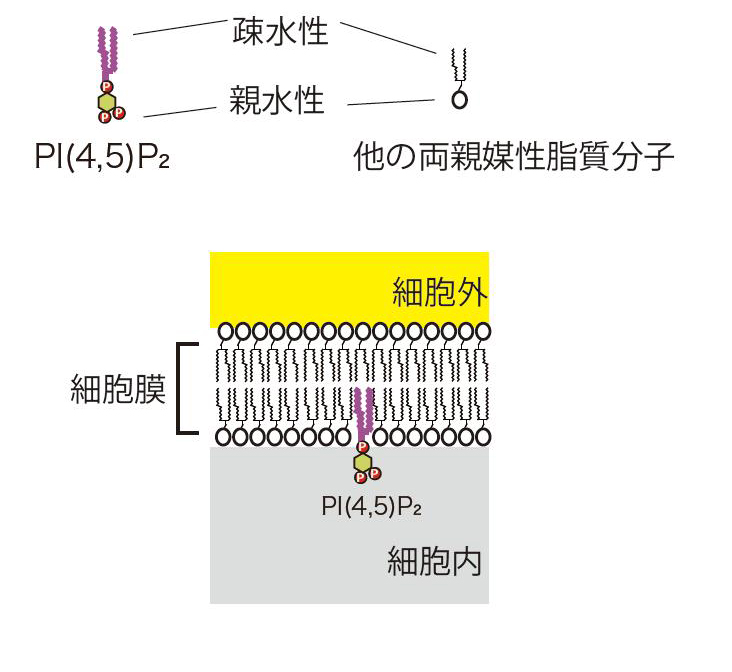
図2 脂質膜の模式図:細胞膜を含む生体膜は、両親媒性の脂質分子により形成される。生体膜では、両親媒性脂質分子の疎水性の部分が、水をはじくことにより集合することで形成される。PI(4,5)P2は生体膜を構成する両親媒性脂質のうちフォスファチジルイノシトール(PI)が、リン酸を付加されて形成される。
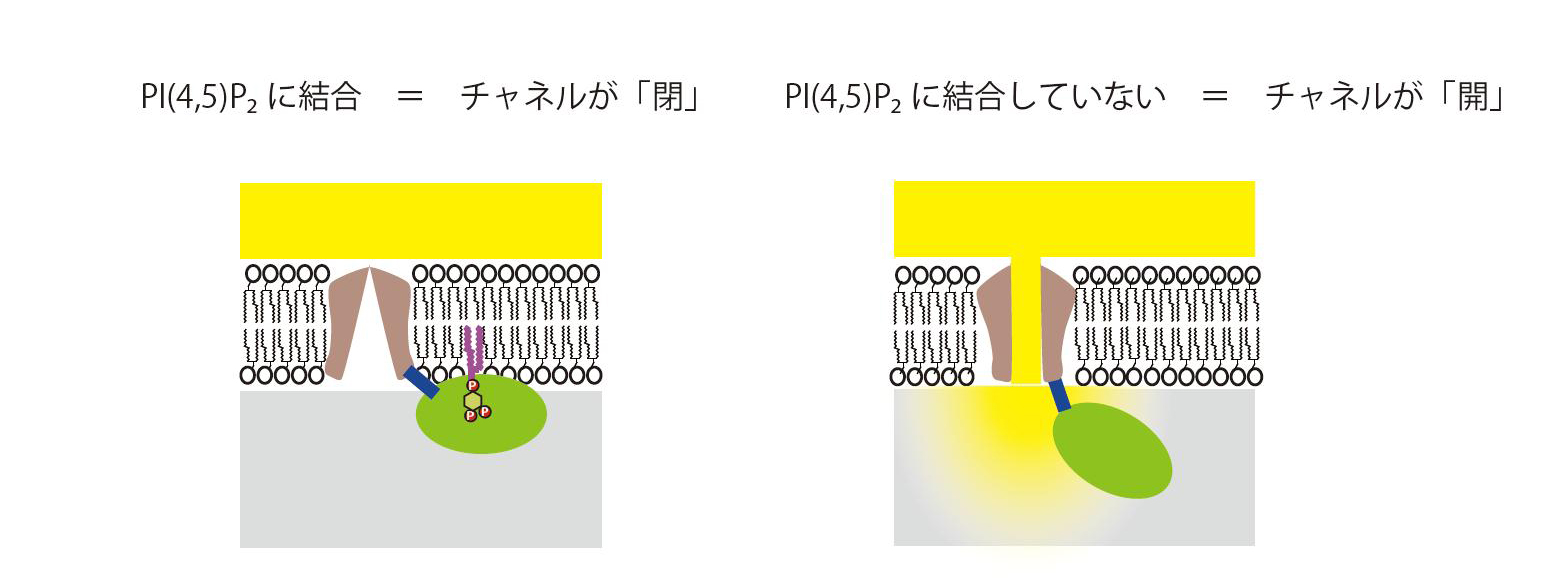
図3 TRPV4のPI(4,5)P2による制御:アンキリンリピートドメインがPI(4,5)P2に相互作用した状態では、チャネル領域のイオン透過性が低く(閉じた状態)、結合していない状態では、イオン透過性が高い(開いた状態)。このことは、アンキリンリピートドメインとPI(4,5)P2の結合が、チャネル領域のイオン透過性を何らかの方法で調節していることを示唆している。チャネルが開くと、細胞外からイオンが細胞内に流入し、さまざまな生体反応が誘導される。
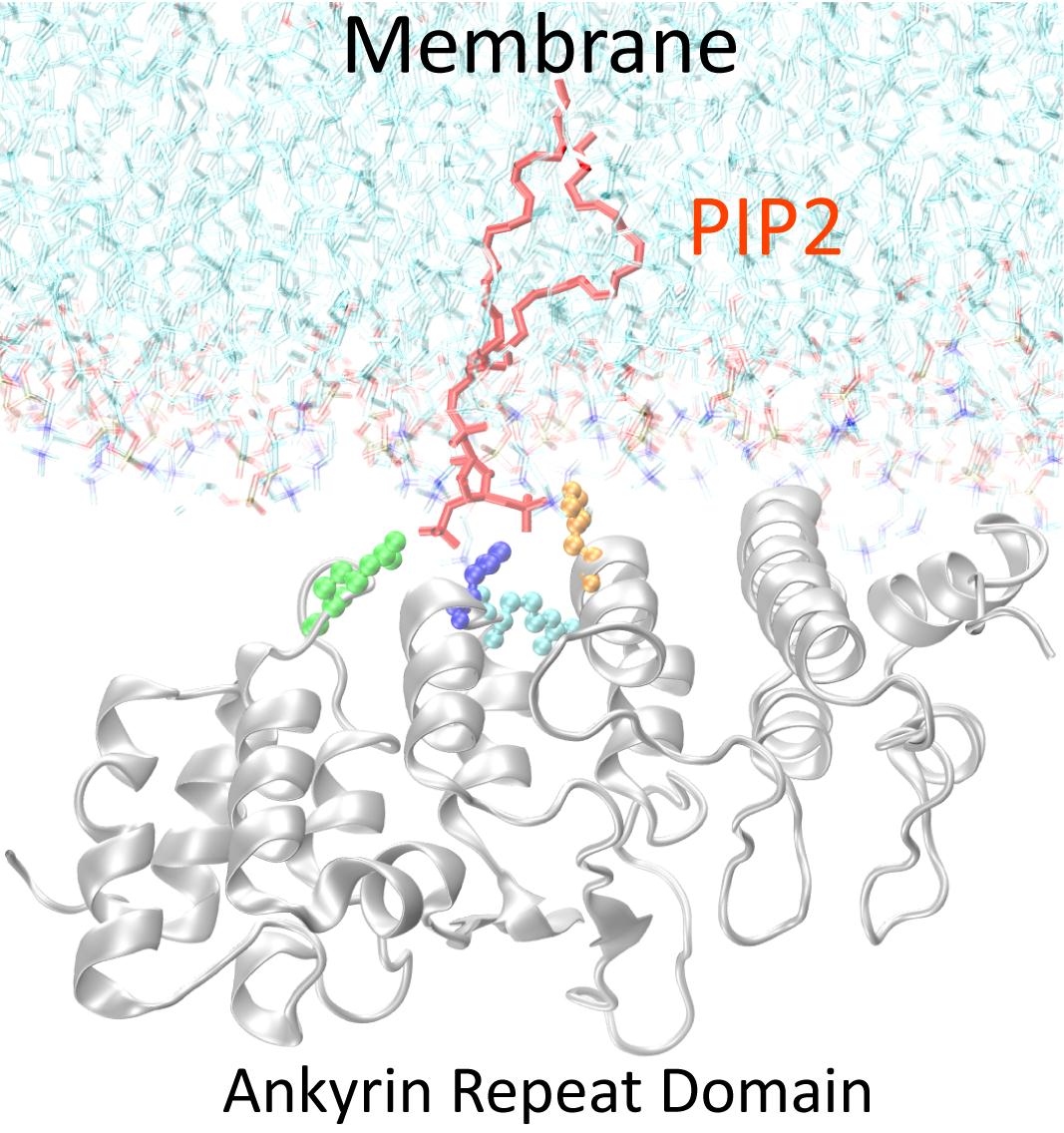
図4 TRPV4とPI(4,5)P2の結合の様式: X線結晶解析、分子動力学計算より作成したTRPV4アンキリンリピートドメインと脂質膜の結合モデル
(2014年10月14日掲載)
 奈良先端科学技術大学院大学
奈良先端科学技術大学院大学