チオ硫酸(硫黄化合物)を細菌の体内に取り込む運び屋タンパク質YeeEの構造を解明 ~システインの発酵生産向上に期待~
チオ硫酸(硫黄化合物)を細菌の体内に取り込む運び屋タンパク質YeeEの構造を解明
~システインの発酵生産向上に期待~
【発表のポイント】
・細菌の生体膜にある機能未知のタンパク質YeeEがチオ硫酸を特異的に取り込むことを発見
・YeeEは分子内で擬似222回転対称性をもつ新規の砂時計のような構造であることを解明
・YeeEの高機能化によってシステインなどの高付加価値化合物の発酵生産への応用に期待
【概要】
奈良先端科学技術大学院大学(学長:横矢直和)先端科学技術研究科バイオサイエンス領域構造生命科学研究室の塚﨑智也教授、田中良樹助教、吉海江国仁研究員、竹内梓(博士前期課程2年)、市川宗厳助教らは、ストレス微生物科学研究室の高木博史教授、構造生物学研究室の箱嶋敏雄教授、味の素-ジェネティカ・リサーチ・インスティテュート社(在モスクワ)の野中源主任研究員、東京大学定量生命科学研究所の森智行助教等との共同研究により、細菌がアミノ酸合成に利用するチオ硫酸という化合物を体内に取り込む際に、運び屋となる膜タンパク質(YeeE)の構造を世界で初めて解明しました。さらに、取り込みの仕組みについて新しい分子メカニズムを提唱しました。チオ硫酸は、細菌の体内でシステインなど高付加価値のアミノ酸の合成に使われるので、発酵生産への応用が期待されます。
細菌には硫黄源としてチオ硫酸を取り込む機構があります。今回は、チオ硫酸の取り込みに特化した膜タンパク質YeeEを同定しました。このタンパク質は生体膜の中にあり、詳細構造は不明だったため、X線結晶構造解析という手法によって、輸送のときの結合状態であるYeeEとチオ硫酸イオン複合体について、その結晶構造を2.5 Å分解能という高分解能で決定しました。
その結果、YeeEは、これまでのタンパク質には例がない折りたたみ構造をしており、細胞の内側と外側にくぼみをもつ砂時計型の構造をとっていました。また、複合体の結晶構造は、細胞外側のくぼみにチオ硫酸が結合している状態であり、この状態はチオ硫酸を輸送する初期の段階を示していると考えています。さらに、X線結晶構造解析の電子マップ、分子動力学計算によるシミュレーションなどによって、推定輸送経路に沿ってチオ硫酸が、保存されたシステイン残基と過渡的に相互作用しながら取り込まれていくモデルを提唱しました。このYeeEの詳細構造の情報は、細菌によるシステイン発酵生産研究の基盤を提供するもので、今後の展開が期待されます。システインには活性酸素を減らす抗酸化能があることから、医薬品や化粧品、食品などの工業原料としても広く用いられています。近年、微生物による発酵生産が工業化されており、さらなる生産性の向上が望まれています。
この研究成果は、米国東部時間(夏時間)の2020年8月26日(水)午後2時(日本時間2020年8月27日(木)午前3時)付で、Science Advances(サイエンス・アドバンシス)に掲載されました。
塚﨑智也教授のコメント

当初,奈良先端科学技術大学院大学ストレス微生物科学研究室(高木研究室)と味の素株式会社にてシステインの合成に関与するトランスポーターYeeEの機能解析が進められていました。しかし,YeeEの分子メカニズムの詳細を知るためにはその構造情報を知る必要があり,本共同研究が開始しました。この論文では,YeeEがチオ硫酸を特異的に運ぶ役割を確かめ,その構造情報を詳細に明らかにしたことでチオ硫酸輸送メカニズムについて多くの知見を得ました。また,論文を仕上げるときには輸送基質のチオ硫酸とYeeEの相互作用を調べるため箱嶋敏雄教授らにもお世話になりました。YeeE/YedEファミリータンパク質の初めての詳細構造の報告は,産業的なシステイン合成系の効率化にも学術的にも大きな影響を与えるものです。
【背景】
硫黄(元素記号S)は、無機硫黄化合物・有機硫黄化合物として地球上に存在しています。硫黄は様々な化合物に取り込まれ、形を変えながら地球の大気・土壌・水中・生態内を循環しています。細菌や植物は環境中に存在する無機硫黄化合物を取り込み、アミノ酸の一種であるシステインやメチオニンなど有機硫黄化合物に変換し利用します。これは、地球上の硫黄循環の一端を担っています。
モデル生物である大腸菌では、ABC輸送体と総称される膜の運び屋の一種である、CysUWA複合体というタンパク質が硫酸イオンとチオ硫酸イオンを細胞質内に取り込むことが示されていました(図1 左・中央)。今回の研究により,大腸菌を用いた遺伝学的な解析とYeeEとチオ硫酸の結合実験から、機能未知とされていた膜タンパク質YeeEがチオ硫酸の取り込みに関連しているということが新たに判明しました(図1 右)。
これまでyeeEの遺伝子の機能が分からなったことから、YeeEの解析はほとんど行われておらず、YeeE/YedEファミリーに分類されるタンパク質の構造情報もない状況でしたが、私たちの研究グループはYeeEによるチオ硫酸イオンの取り込み機構を理解するために、YeeEのX線結晶構造解析と構造情報に基づく構造生物学的解析を行いました。
【解析の方法と結果】
本研究では、Spirochaeta thermzophila という細菌の膜タンパク質YeeEを純化して、輸送基質であるチオ硫酸と共に結晶化させました。
その後、YeeEの結晶を用いたX線回折データは大型放射光施設SPring-8*1 で収集しました。最終的にX線結晶構造解析によって、2.5 Å分解能*2という高精度のデータからYeeEの結晶構造を明らかにしました。
本研究により決定されたYeeEの構造は完全に新規のフォールド(折りたたまれた構造)*3をとっていました(動画1、図2)。YeeEには1つのループと3本のアルファヘリックス構造が4回繰り返した構造があり、それらが分子内で擬似222対称性という回転対称(擬似222回転対称*4)のパターンで配置する特徴があります(図3)。それぞれの繰り返し構造に存在する計4つのループLA、LB、LC、LDがYeeEの中心部に向かって位置し、これらのループを取り囲むようにアルファヘリックス(タンパク質の右巻きらせん構造)が配置しています。
この配置により、YeeEは細胞内側と外側にくぼみをもつ砂時計型の構造体をとっています(図4)。チオ硫酸イオンは細胞外側に存在する正電荷のくぼみにシステイン残基と水素結合し位置しています(図2)。この位置をポジションIとします。ループで形成される中心部には生物種間で保存性の高い3つのシステイン残基(C293、C91、C22)が連続して配置していて(動画1、図2)、これらのシステイン残基はYeeEによるチオ硫酸輸送活性にかかわる重要な働きをしています。
このような結晶構造によりチオ硫酸イオンが位置するポジションIから3つのシステイン残基を介して基質が細胞内に取り込まれると考えました。
また、X線結晶構造解析の電子密度マップから、YeeEの基質経路と予測されている領域でシステイン残基近傍にチオ硫酸が留まりそうなポジションII、ポジションIIIを見出しました。(図4)。さらに、分子動力学計算*5という手法で調べたところ、YeeEが大きな構造変化をしなくても、チオ硫酸イオンがポジションII、IIIに安定して存在することが分かりました。
ここでの構造生物学的解析をまとめ、「YeeEは保存された砂時計型の構造を持ち、3つのシステイン残基の各チオール基(--SH基)とチオ硫酸の硫黄原子との間で一時的に結合しながらチオ硫酸イオンを細胞内へ運ぶ輸送体(トランスポーター)である」というモデルを提唱しました(図4)。興味深いことは、YeeEが中心部の最小限の構造変化でチオ硫酸の輸送を可能にできるという点で、チオ硫酸取り込みに特化して進化した洗練された構造体のようにみられます。
【今後の展開】
今回の成果は、チオ硫酸を特異的に輸送するタンパク質としてYeeEを同定し、YeeEの詳細構造をX線結晶構造解析により初めて明らかにしたことです。この新規フォールドの発見により研究が遅れていたYeeE/YedEファミリーと総称されるタンパク質の詳細な分子メカニズムの解析が可能となるだけでなく、輸送体などが関わる輸送の分子機構に対する理解が深まることで、タンパク質構造予測技術の向上などの構造生物学に関する基盤研究の発展に資することができます。
一方で、YeeEによるチオ硫酸の取り込みは、細胞内のシステイン合成における重要な経路の一つです。環境に優しい細菌によるシステインの発酵生産の能力を向上させるためには、硫黄源を取り込むシステムの一つであるYeeEを介した経路の強化が有用なアプローチです。今回明らかにしたYeeEの構造と輸送メカニズムをもとに、チオ硫酸を取り込む能力が著しく高まった「スーパーアクティブYeeE」を創製することで、システインの生産性向上が可能になります。
また、微生物の増殖に硫黄源は必須ですが、一般に用いられる硫酸に比べ、チオ硫酸には増殖に必要なATPやNADPHなどのエネルギー源を細胞内で節約できるメリットがあります。したがって、チオ硫酸を「スーパーアクティブYeeE」によって効率よく取り込む微生物を育種することで、システイン以外のアミノ酸や有機酸、バイオ燃料や医薬品原料などの高付加価値化合物の生産性を高め、製造コストを下げることが期待できます。
【用語等解説】
※1 SPring-8:兵庫県佐用町に位置する世界最大級の大型放射光施設。強いX線を用いた実験が可能。
※2 分解能:対象物をどの程度まで識別できるかという能力。本稿での高い分解能とは、その値(単位はÅ)がより低いものを指し、それだけ細部まで識別可能になる。
※3 フォールド(折りたたまれた構造):タンパク質はアミノ酸が連結したポリペプチドで構成されており、多くの場合ポリペプチドがフォールドして(折りたたまれて)ある特定の構造体を形成し機能する。
※4 擬似222回転対称:同一ではない部分構造が三方向の直交する軸に対して、ほぼ180度の回転対称性をもった位置関係であること。
※5 分子動力学計算:分子動力学(Molecular Dynamics)を用いて、タンパク質などの生体分子の挙動を計算する研究手法。MDシミュレーション。
【解説図・解説動画】
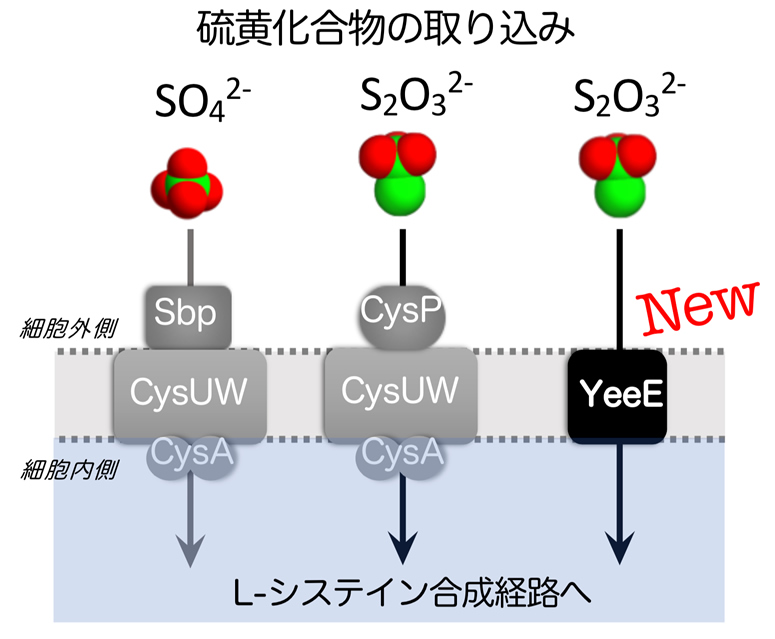
図1:硫黄化合物取り込みの模式図。硫酸イオンSO42- およびチオ硫酸イオンS2O32- は専用の経路を通り、細胞内へ運ばれ、システイン合成に利用される。本研究でYeeEがチオ硫酸イオンの取り込みに関与することが分かった。
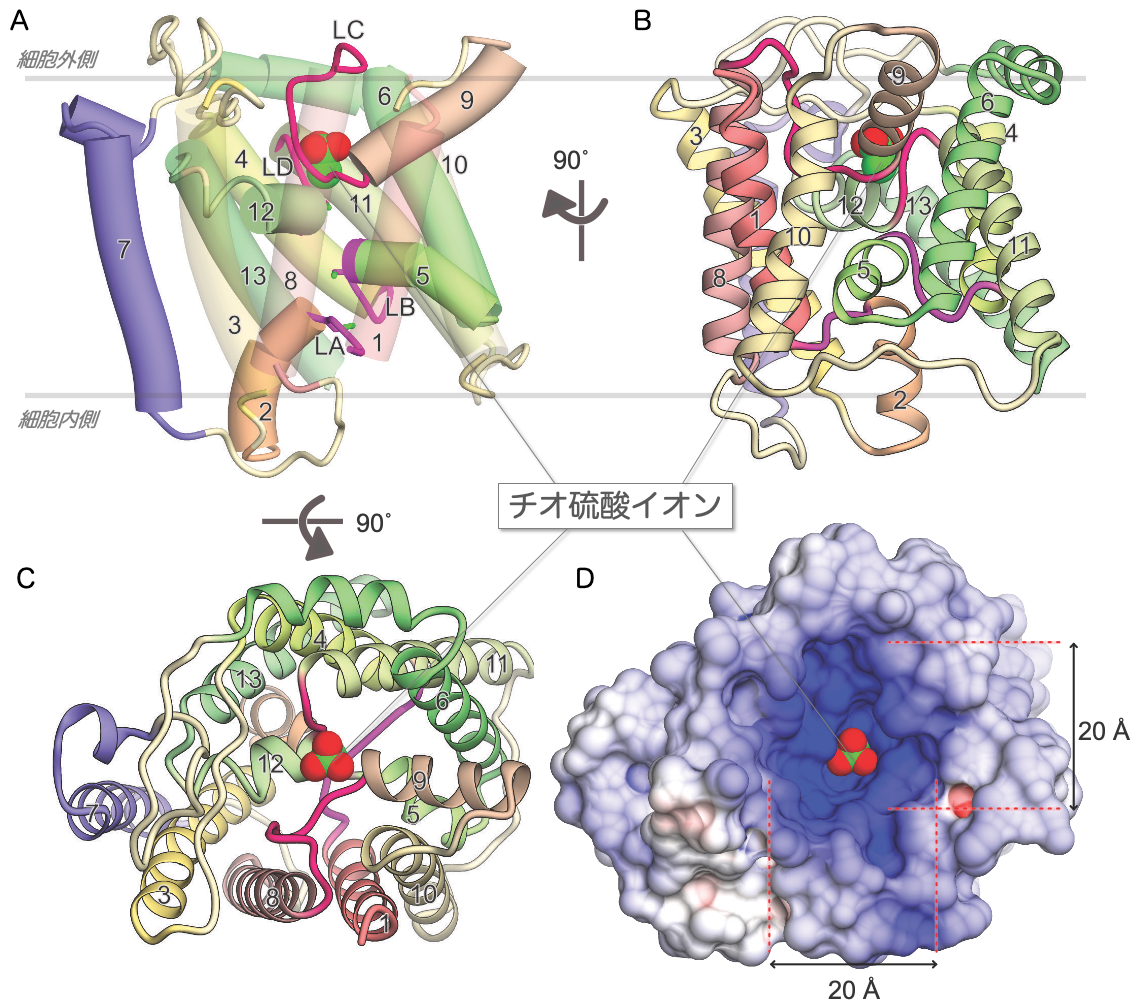
図2:YeeEの構造モデル図。アルファヘリックス(右巻きらせん構造)の番号を数字で表した。中心部に存在するループをLA〜LDで示し、チオ硫酸イオンを赤色と緑色の空間充填モデルで示している。(A) はアルファヘリックスをシリンダー表示、(B)、(C) はリボン表示した。(D) は細胞外側から見たタンパク質の表面表示モデル(Cと同一視点)であり、くぼみは正に帯電している(青:正電荷、赤:負電荷)ことを示す。
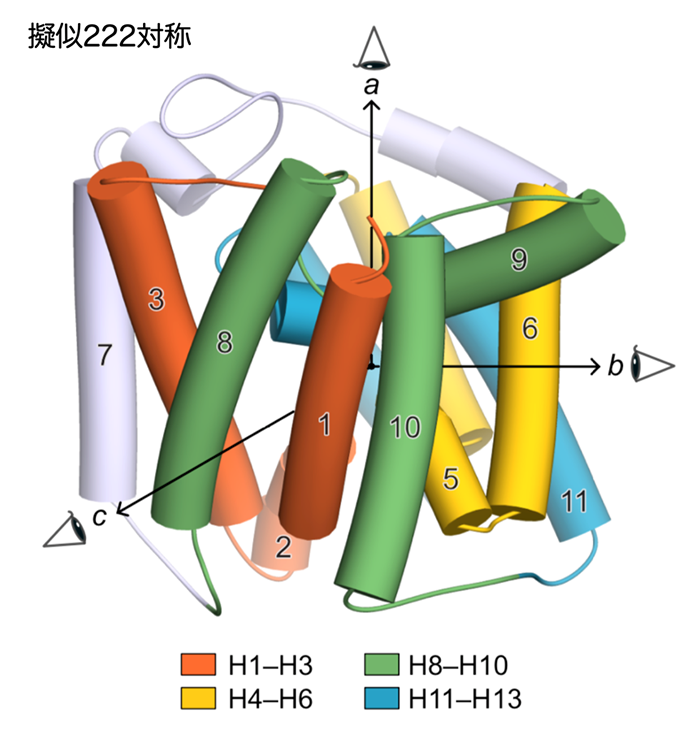
図3:YeeEの擬似222対称。左図: 完全な222対称のモデル『ブロウ生命系のためのX線解説入門』(化学同人)から引用)。表示した対称軸を中心に180度回転させると「手」がぴったりと重なる。右図: YeeEのアルファヘリックスはシリンダー表示し、その番号を表示した。色分けしたYeeEの4つの部位(H1〜H3、H4〜H6、H8〜H10、H11〜H13)が擬似対称構造となっている。表示した3つの直行した軸 a、b、cが対称軸で、各軸を中心に180度回転させることでそれぞれの部位が重なる擬似2回対称がある。
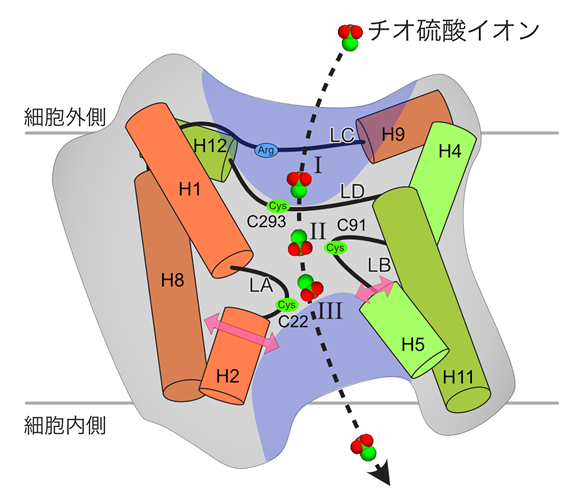
図4:YeeEによるチオ硫酸の取り込みモデル。YeeEの断面図を示す。LA、LB、LC、LDのループとその近傍のアルファヘリックスを強調して描写した。LCに保存されたアルギニン(Arg)とLA、LB、LDに存在する3つの保存されたシステイン(Cys)を図示した。チオ硫酸イオンは、まずポジションIの位置で認識され、保存されたシステイン残基付近を矢印に沿ってポジションII、IIIを経由し、膜を通過し細胞内に放出される。
【掲載論文】
論文タイトル:Crystal structure of a YeeE/YedE family protein engaged in thiosulfate uptake(チオ硫酸の取り込みに関わるYeeE/YedEファミリータンパク質の結晶構造)
書誌情報:Yoshiki Tanaka, Kunihito Yoshikaie, Azusa Takeuchi, Muneyoshi Ichikawa, Tomoyuki Mori, Sayaka Uchino, Yasunori Sugano, Toshio Hakoshima, Hiroshi Takagi, Gen Nonaka and Tomoya Tsukazaki
(田中 良樹、吉海江 国仁、竹内 梓、市川 宗厳、森 智行、内野 清香、菅野 泰功、箱嶋 敏雄、高木 博史、野中 源、塚崎 智也)
【構造生命科学研究室】
https://bsw3.naist.jp/courses/courses309.html
https://bsw3.naist.jp/tsukazaki/
(2020年08月28日掲載)
 奈良先端科学技術大学院大学
奈良先端科学技術大学院大学