2023.04.03
樹状細胞の移動のための推進力発生機構の解明
神経システム生物学研究室・助教・馬場 健太郎
- 要旨
- 免疫細胞の一種である樹状細胞は、皮膚や肺、腸などの様々な組織に分布し、体内に侵入した細菌やウイルスなどの病原体を取り込んだ後、リンパ管を通ってリンパ節へ移動し、T細胞へ病原体の抗原を提示します。これによりT細胞による病原体排除のための免疫応答が誘導されることが知られています(図 1)1)。この様に、免疫応答を誘導するためには樹状細胞の移動が重要であり、樹状細胞移動の破綻は病原体感染の抵抗力減少といった免疫応答の障害を引き起こすことが報告されています2, 3)。しかしながら、樹状細胞が移動するための推進力が、どのように生み出されるのか、その分子機構はよく解っていません。我々の研究室では、樹状細胞の移動の推進力の発生にShootin1(シューテイン)という分子が関与することを見出しました。本稿では、Shootin1に着目した樹状細胞の移動の分子機構について紹介します。
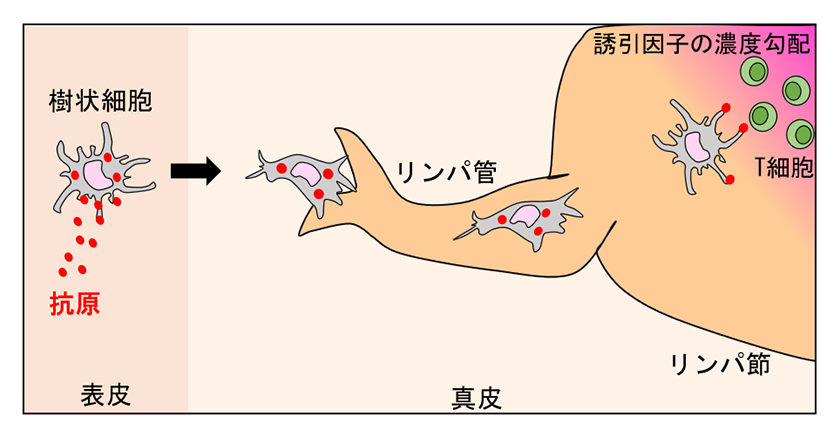
図1.生体内における樹状細胞の移動
樹状細胞は、表皮や肺、腸などの様々な組織に分布し、体内に侵入した細菌やウイルスなどの病原体を取り込んだ後、リンパ管を通ってリンパ節へ移動する。リンパ節へたどり着いた樹状細胞は誘引因子(CCL19)の濃度勾配に沿ってT細胞まで移動しT細胞へ病原体の抗原を提示する。
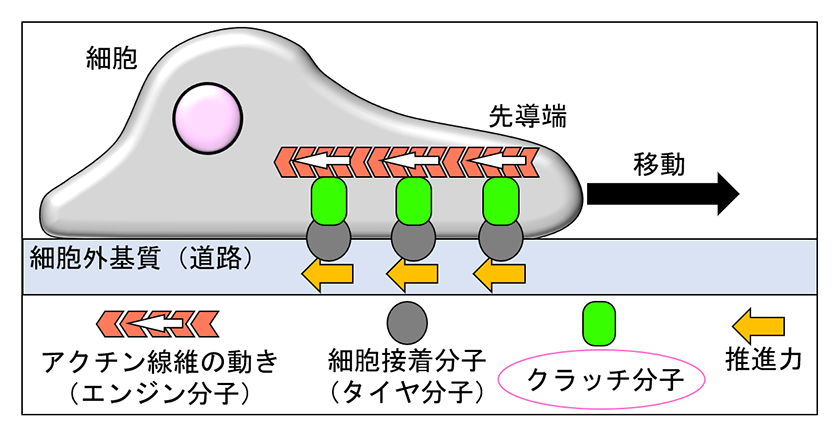
1.クラッチ分子を介した細胞移動
細胞移動は、受精や免疫反応、神経回路形成、大脳皮質層の形成、上皮組織修復など、様々な生命機能に関わっており細胞移動の破綻により不妊や免疫不全、脳の奇形症、上皮組織の形成不全、さらには、がん浸潤などの病態が引き起こされることから細胞移動は生命機能にとって必要不可欠なものです。
細胞移動のモデル(図 2)では、細胞先導端でエンジン分子として想定されるアクチン線維の動き(図 2)が、タイヤ分子として想定される細胞接着分子(図 2のタイヤ分子)を介して細胞外基質(図 2の道路)に伝わり推進力を生み出すと考えられています4)。これらエンジン分子とタイヤ分子を連結する分子がクラッチ分子(図 2の緑色)であり、クラッチ分子は細胞移動の推進力発生に中心的な役割を果たします。我々の研究室では、Shootin1が神経細胞においてアクチン線維と細胞接着分子L1を連結するクラッチ分子としてはたらき、Shootin1が神経突起伸長を促進することを証明しました5, 6, 7)。さらに、Shootin1が樹状細胞に発現することを見出しました8)。
これまで樹状細胞の移動機構を明らかにするために、樹状細胞の移動に関与する誘引物質やその受容体の同定、細胞内のシグナル伝達機構の解析が行われてきましたが、樹状細胞におけるクラッチ分子の同定やクラッチ分子に着目した移動機構の解析はほとんど行われておらず、そのため樹状細胞の移動機構の理解が進んでいませんでした。
2.Shootin1は樹状細胞の移動や移動のための推進力の発生に関与する
樹状細胞の移動様式の例として、樹状細胞はリンパ節で分泌される誘引物質CCL19の濃度の高い方向へと移動する(走化性移動)ことが知られています9)。そこで、我々はShootin1が走化性移動や移動のための推進力の発生に関与するか否かを検証しました。具体的には、CCL19の濃度勾配を形成するデバイスに、野生型樹状細胞とshootin1 遺伝子欠損樹状細胞(ノックアウト細胞)を培養しCCL19の濃度の高い方に向かう樹状細胞の移動速度を測定しました(図 3a)。その結果、野生型細胞と比べてノックアウト細胞の移動速度が減少することが解りました。さらに、我々は物理学的な計測法を用いて細胞移動の際に生み出される力を測定しました。具体的には、蛍光ナノビーズを包埋した弾性のゲル上で樹状細胞を培養し、推進力発生の際に動くビーズの挙動とゲルの硬さから細胞移動の推進力を算出しました(図 3b,c)10)。その結果、野生型細胞と比べてノックアウト細胞の推進力が減少することが解りました。これらの結果から、Shootin1は樹状細胞の移動や移動のための推進力の発生に関与することが示唆されました。
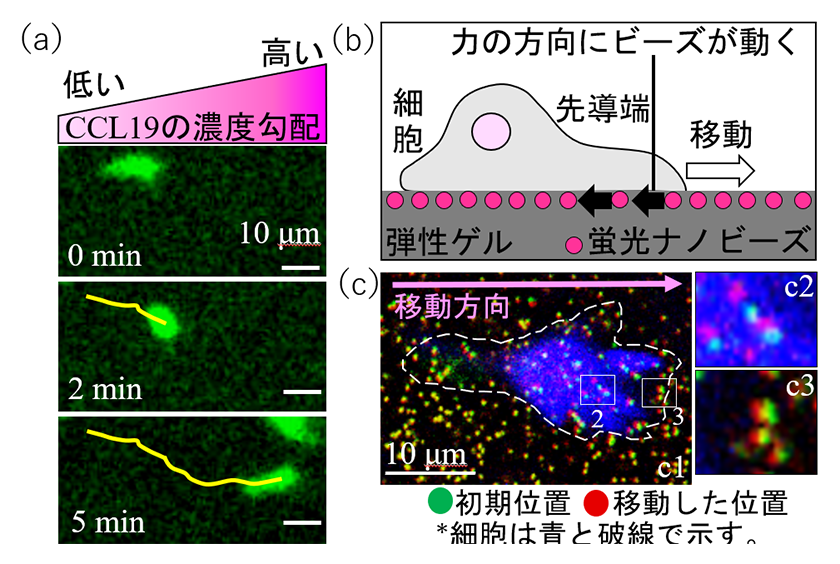
図3.誘引物質CCL19へ向かう樹状細胞移動と細胞移動の推進力の測定
(a)CCL19の濃度の高い方向へ樹状細胞(緑色)は移動する(黄色線は移動の軌跡)。
(b)細胞移動の推進力測定の模式図。
(c)樹状細胞の移動の推進力をゲルに埋め込まれた蛍光ナノビーズで実際に測定した。緑色はビーズの初期位置、赤色は推進力により動いたビーズの位置を示す。図c1の枠線2, 3の拡大図を図c2,c3に示す。
3.おわりに
これまで樹状細胞におけるクラッチ分子の存在が不明だったため、樹状細胞の移動のメカニズムはよく解っていませんでした。今回の我々の研究結果から、クラッチ分子Shootin1が樹状細胞の移動や移動のための推進力発生に関与することが示唆されました。今後は、生化学的な相互作用解析や1分子計測法などを用いて、樹状細胞の移動においてShootin1がクラッチ分子として機能するか否かをより詳細に検証していきます。
細胞移動は脳内の神経回路形成や上皮組織の修復、がん細胞の浸潤、個体発生など様々な生命機能に関わります。我々の研究によりShootin1が細胞移動のための推進力を引き起こすという機構を発見しました。この発見は樹状細胞の移動を研究する分野だけでなく、細胞生物学、神経科学、発生生物学といった様々な分野の新たな進展につながることが期待できます。また、本稿では示しませんでしたが、Shootin1を欠損した場合ではマウス生体内においてリンパ節へ向かう樹状細細胞の移動が阻害されることが解りました。すなわち、生体内においてshootin1欠損による樹状細胞移動の阻害が免疫応答障害を引き起こす可能性が示唆されました。今後、shootin1ノックアウトマウスを免疫障害のモデルマウスとして用いて免疫応答の障害の原因解明や治療法の開発研究に貢献することが期待されます。
参考文献
- Worbs, T. et al. (2017) Nat. Rev. Immunol. 17, 30-48
- Ato, M. et al. (2006) J. Immunol. 176, 5486-5493
- Gutiérrez-Kobeh, L. et al. (2018) IntechOpen. 79491, 47-78
- Mitchison T. and Kirschner M. (1988) Neuron. 1, 761–772
- Shimada, T. et al. (2008) J. Cell Biol. 181, 817-829
- Kubo, Y. et al. (2015) J. Cell. Biol. 210, 663-676
- Baba, K. et al. (2018) eLife. 7, 1-35
- Higashiguchi, Y. et al. (2016) Cell Tissue Research. 366, 75-87
- Tiberio, L. et al. (2018) Cell. Mol. Immunol. 15, 346-352
- Toriyama, M. et al. (2013) Current Biology. 23, 529-534
馬場 健太郎 NAIST Edge BIO, 0011. (2023)