異常タンパク質の蓄積を効率良く知らせる仕組みを解明。XBP1 mRNAの局在化が鍵
細胞の中で異常タンパク質が蓄積した場合、細胞は異常タンパク質を処理するシステムを駆動させて細胞を守る。バイオサイエンス研究科動物細胞工学講座の柳谷耕太院生(現博士研究員)と河野憲二教授とは異常タンパク質の蓄積に応じてこのシステムを効率よく駆動させる仕組みを明らかにした。本研究はMol. Cell誌のトピックスとしてPreviewで解説されるとともに、4月24日号の表紙にも採用された。
掲載論文
 Cotranslational targeting of XBP1 protein to the membrane promotes cytoplasmic splicing of its own mRNA. Yanagitani, K., Imagawa, Y., Iwawaki, T., Hosoda, A., Saito, M., Kimata, Y., and Kohno, K. Molelular Cell vol 34, 191-200 (2009)
Cotranslational targeting of XBP1 protein to the membrane promotes cytoplasmic splicing of its own mRNA. Yanagitani, K., Imagawa, Y., Iwawaki, T., Hosoda, A., Saito, M., Kimata, Y., and Kohno, K. Molelular Cell vol 34, 191-200 (2009)
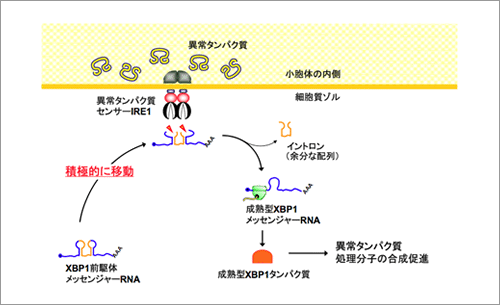
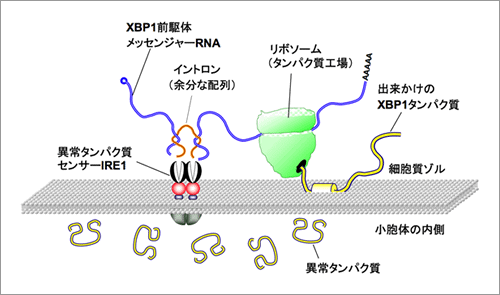
すべてのタンパク質は多数のアミノ酸が連なったひも状の分子として合成され、正しい形に折り畳まれることにより、正常な機能を獲得する。コラーゲンやインスリンなどの細胞外で働くタンパク質は小胞体で折り畳まれるが、細胞がさまざまな異常環境に晒されると、小胞体の働きに障害が生じ、折り畳みが不完全な異常タンパク質が小胞体の内部に大量に生み出されることとなる。この様な異常事態に応じて細胞は小胞体の異常タンパク質の修復や分解を行う分子の合成量を増大させるシステムを駆動させて異常タンパク質の毒性から細胞を守る。これまで、この異常タンパク質応答機構の最も重要なステップとして、小胞体に存在する異常タンパク質センサー分子IRE1αがXBP1と呼ばれる遺伝子のmRNAから余分な配列(イントロン)を切り取る反応が知られていたが、そもそも両者がどの様に出会うかについては全く明らかになっていなかった(図1)。今回XBP1 mRNAと小胞体にあるIRE1αが出会うメカニズムの解明に取り組んだ結果、イントロンを除去される前の(前駆体)XBP1u mRNAは自身の遺伝暗号から合成するXBP1uタンパク質を錨のように利用して小胞体から離れないようにしていることが分かった(図2)。さらに、XBP1前駆体mRNAが小胞体上に留まることでIRE1αが感知した異常タンパク質蓄積という情報を効率よく伝え、異常タンパク質処理システムを駆動していることが明らかとなった。異常タンパク質の蓄積はコンフォーメンション病(神経変性疾患や一部の糖尿病など)の誘因になるものであり、異常タンパク質処理システムを効率よく駆動する仕組みを明らかにする今回の研究は、これら疾患の病因解明にも貢献できると期待される。
また、この発見は異常タンパク質が蓄積した情報を素早く伝達する仕組みを明らかにしただけでなく、mRNAをある場所に局在化させるためにコードされているタンパク質を利用するという新たなmRNAの局在化機構を見出した点でも興味深い。
(図1) XBP1前駆体メッセンジャーRNAの小胞体膜局在化メカニズムの模式図
(図2) XBP1前駆体メッセンジャーRNAのスプライシング反応の模式図
(2009年04月30日掲載)
 奈良先端科学技術大学院大学
奈良先端科学技術大学院大学