2022.12.01
細胞突起からの新たな細胞外小胞の形成機構と生理的な役割
分子医学細胞生物学研究室・助教・西村 珠子
- 要旨
細胞外小胞(extracellular vesicles:EVs)は、多くの細胞が分泌する脂質膜小胞で、様々なタンパク質や核酸を内包しています。分泌後、受容細胞に取り込まれ、細胞間のシグナル伝達を行う一方で、がんや神経変性疾患等の疾患形成に関与することが知られています。
細胞外小胞は、細胞内のエンドソームに由来する小胞と、細胞膜に由来する小胞の、主に2種類に分類されます。このうち、エンドソーム由来の細胞外小胞については、これまで分泌機構が詳しく研究されてきました。一方、細胞膜由来の細胞外小胞については、細胞膜からの分泌機構と、受容細胞における生理機能が、ほとんど分かっていませんでした。
私たちは、最近、細胞膜に結合して膜の形態を制御するBin-Amphiphysin-Rvs (BAR)ファミリータンパク質のうち、細胞突起を形成するMIMは、切断されやすい細胞突起を形成することで、細胞膜由来の細胞外小胞の形成に関与することを、初めて見いだしました1, 2)。また、MIMの作用により分泌された細胞外小胞は、内包されたシグナル分子を介して、がん細胞を含む受容細胞の細胞運動を促進しました。従って、MIMにより分泌される細胞外小胞は、がんの浸潤・転移に関与する可能性が示唆されました。
本稿では、細胞突起由来の細胞外小胞の分泌機構と生理機能に関する、私たちの研究を紹介します。
- 主要関連論文
1) Nishimura T, Oyama T, Hu HT, Fujioka T, Hanawa-Suetsugu K, Ikeda K, Yamada S, Kawana H, Saigusa D, Ikeda H, Kurata R, Oono-Yakura K, Kitamata M, Kida K, Hikita T, Mizutani K, Yasuhara K, Mimori-Kiyosue Y, Oneyama C, Kurimoto K, Hosokawa Y, Aoki J, Takai Y, Arita M, Suetsugu S. (2021) Filopodium-derived vesicles produced by MIM enhance the migration of recipient cells. Developmental Cell. 56(6):842-859.e8.
doi: 10.1016/j.devcel.2021.02.029.2) D'Angelo G, Raposo G, Nishimura T, Suetsugu S. (2022) Protrusion-derived vesicles: new subtype of EVs? Nature Reviews Molecular Cell Biology. Oct 24. doi: 10.1038/s41580-022-00555-x.
1.細胞外小胞
細胞外小胞(EVs: Extracellular vesicles)は細胞が分泌する脂質二重膜の小胞で、様々なタンパク質やmiRNAを内包しています。そして、分泌された細胞外小胞は、周辺の細胞や、血流等を介して遠隔の細胞に取り込まれて、免疫細胞の活性化や、発生における形態形成シグナルの伝達等の、細胞間シグナル伝達に関与することが報告されています3)。
一方、細胞外小胞は、がんや神経変性疾患などの、様々な疾患に関与することが知られています。特にがん細胞は、細胞外小胞を多く分泌し、がんの悪性化を引き起こします。がん細胞が分泌する細胞外小胞は、がん特異的な分子を内包し、細胞の増殖・浸潤や血管新生を促進すると共に、特異的な組織への転移を促進することが報告されています4)。
細胞外小胞は、細胞内のタンパク質分解経路であるエンドソームに由来するエクソソームとも呼ばれる小胞と、細胞膜に由来する小胞に大きく分類されます(図1)。このうち、エンドソーム由来の小胞は、大きさが約50-150 nmで、これまでに分泌機構が詳しく研究されており、エンドソームが陥入して多胞体が形成され、多胞体が細胞膜に運ばれて膜融合し、中の小胞が分泌されるという分泌機構が提唱されています3)。一方、細胞膜由来の小胞は、大きさが約50-1000 nmで、がん細胞が分泌することが報告されていたものの5)、分泌数がエンドソーム由来の小胞の約10分の1と少ないことや、細胞膜を切断する分子が同定されていなかったことなどから、分泌機構や生理機能の解明が遅れていました。
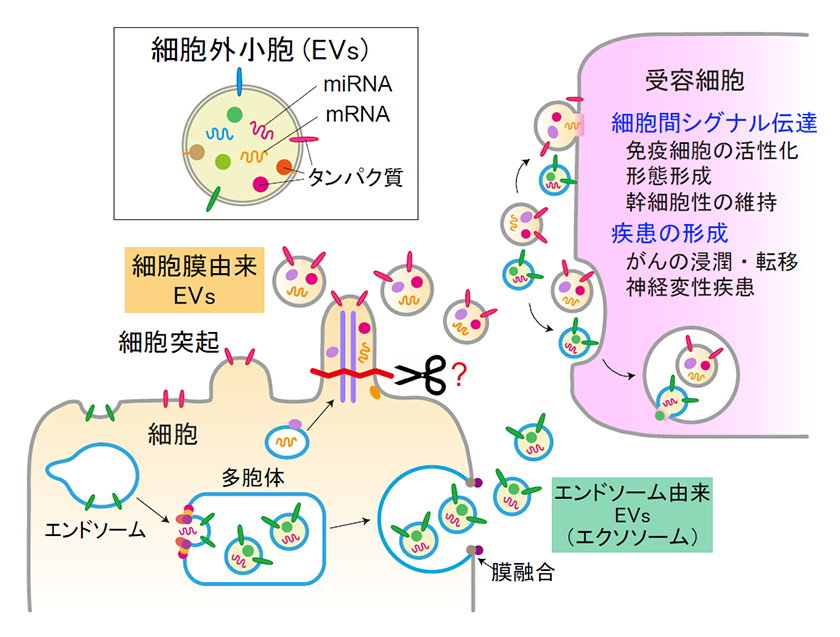
図1.細胞外小胞の形成と、受容細胞における機能
細胞外小胞は、細胞が分泌する膜小胞で、エンドソーム由来の小胞と細胞膜由来の小胞に大きく分類される。エンドソーム由来の細胞外小胞は、エンドソームの陥入により形成された多胞体が細胞膜に運ばれて、中の小胞が分泌される。一方、細胞膜由来の細胞外小胞は、細胞突起が切断されることにより分泌される。分泌された細胞外小胞は、受容細胞に取り込まれ、細胞間のシグナル伝達や、がん等の疾患の形成に関与する。
2.I-BARタンパク質MIMによる細胞外小胞の形成と、細胞移動の促進作用
私たちは、脂質膜に結合して多量体を形成し、鋳型として膜の形態を制御するBARファミリータンパク質について、研究を進めてきました6)。BARファミリータンパク質のサブファミリーであるI-BARタンパク質は、哺乳類では5種類が知られ、細胞膜に結合して細胞膜を変形することにより、糸状仮足(フィロポディア)と呼ばれる細胞突起の形成を担っています。そこで私たちは、I-BARタンパク質の一種であるMIMが形成する細胞突起が切断され、細胞膜由来の細胞外小胞が形成される可能性について調べました1, 2, 7)(図2A)。
まず、MIMの膜結合ドメインで活性化体として機能するI-BARドメインの精製タンパク質を、人工脂質膜リポソームの内側に入れたところ、細胞突起が形成・切断され、膜小胞が形成されました(図2B)。また、MIMを培養細胞に発現すると、細胞突起が形成され、かつ細胞の周囲に小胞が形成されました。そこで、MIMを発現した細胞のライブイメージングを行ったところ、MIMによって形成されたと思われる細胞突起が実際に切断される様子が観察されました(図2C)。また、MIMによる細胞突起の切断は、血流相当の外力により、促進されることも分かりました。
そこで、MIMを発現した細胞の培養上清を集めて、細胞外小胞画分を調製しました。すると、細胞膜由来の細胞外小胞を多く含む画分において、細胞外小胞の分泌数が、MIMの発現に依存して増加しました。また、細胞膜由来の小胞画分に含まれるタンパク質を分析したところ、細胞が動く際に機能する葉状仮足の形成に関与する低分子量Gタンパク質Rac1や、細胞移動を促進するとの報告があるインスリン受容体結合分子IRS4の、小胞における含有量が、MIM依存的に増加していました(図2D)。
そこで次に、MIM発現細胞から調製した細胞膜由来の細胞外小胞を、培養細胞に添加したところ、細胞の移動が促進されることが分かりました。これらの作用は、小胞中に含まれるIRS4やRac1の活性に依存していました。さらに、MIM発現細胞の細胞外小胞を、すい臓がん細胞株に添加すると、がん細胞の集団的な移動も促進されました(図2D)。
これらの結果から、MIMは切断されやすい細胞突起の形成を促進することで、細胞膜由来の細胞外小胞の形成に関与することが明らかとなりました。また、MIMにより分泌された細胞外小胞は、内包されたRac1およびIRS4の作用を介して、がん細胞を含む受容細胞の移動を促進することもわかりました。
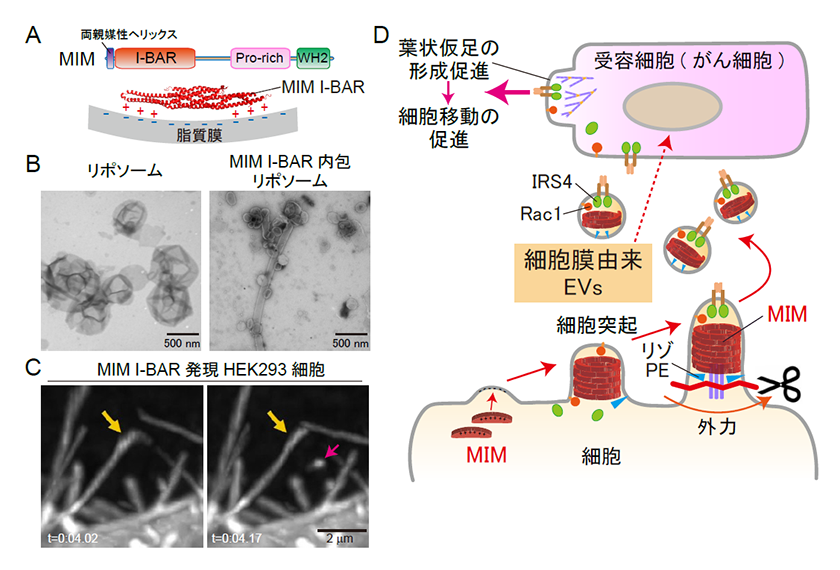
図2.MIMを介した細胞突起からの細胞外小胞の形成と、受容細胞における細胞移動促進
(A)MIM分子の模式図、およびMIM I-BARドメインと脂質膜との結合。Pro-rich: Proline rich領域(SH3ドメインをもつタンパク質との相互作用に関与)、WH2: WH2ドメイン(単量体アクチンの結合に関与)。(B)MIM I-BARタンパク質を内包したリポソーム膜の小胞化。(C)MIM I-BARドメインを発現した細胞における細胞突起の切断。オレンジ色の矢印は切断前(左図)および後(右図)の細胞突起、赤色の矢印は切断された小胞、tは経過時間。(D)MIMによる細胞突起切断を介した細胞外小胞の分泌と、細胞外小胞を受容した細胞における細胞移動の促進。文献7を改変。
3.おわりに
本研究では、細胞突起が切断され細胞膜由来の細胞外小胞が形成される分子機構を、初めて見出しました。また、細胞突起に局在するシグナル分子が、MIM依存的な細胞外小胞に内包され、受容細胞に取り込まれて直接作用するという、新たなシグナル伝達機構を提唱しました。さらに、MIM依存的な細胞外小胞が、がん細胞の運動促進を介して、がんの浸潤や転移に関与する可能性を示しました。
細胞膜由来の細胞外小胞の形成は、ES細胞における幹細胞性の維持8)や、ハエの発生時の成虫原基形成9)にも関与することが報告され、普遍的な現象であると考えられます。また、がん細胞が分泌することから5)、がんの診断マーカーや治療の標的になり得ると考えられます。私たちは、がん細胞からI-BARタンパク質IRSp53による細胞突起形成の促進を通じて分泌される小胞が、がんの細胞増殖を促進する現象も見いだしています10)。
今後、更なる研究を行うことで、細胞膜由来の細胞外小胞の特性を明らかにすると共に、細胞突起切断の活性化機構、小胞の細胞への取り込み機構、がんや神経変性疾患などにおける小胞の分泌亢進機構等を明らかにすることで、疾患の診断や治療の手がかりを得たいと考えています。
参考文献
- Nishimura, T. et al. Developmental Cell (2021)
- D'Angelo, G. et al. Nat. Rev. Mol. Cell Biol. (2022)
- van Niel, G. et al. Nat. Rev. Mol. Cell Biol. (2018)
- Yokoi, A. and Ochiya, T. Semin. Cancer Biol. (2021)
- D'Souza-Schorey, C. and Clancy, J.W. Gene. Dev. (2012)
- Nishimura, T. et al. Biochem. Soc. Trans. (2018)
- 西村珠子、末次志郎 生化学 (2022)
- Hur, Y.H. et al. Dev. Cell (2021)
- Hurbain, I. et al. Cur. Biol. (2022)
- Hu, H.T. et al. BioRXiv (2020)
西村 珠子 NAIST Edge BIO, 0007. (2022)

